Марганец.
Химия элементов

Высшая степень окисления марганца +7 соответствует общему числу 3d- и 4х-электронов и характерна лишь в оксосоединениях типа MnOj, Мп207 и Мп03Е Соединения марганца следует рассматривать как производные соответствующих оксидов. Известны следующие оксиды марганца: оксид марганца (П) МпО (зеленого цвета); оксид марганца (Ш) Мп203 (черного цвета); оксид марганца (1У) Мп02, (черно-бурого цвета… Читать ещё >
Марганец. Химия элементов (реферат, курсовая, диплом, контрольная)
Историческая справка Элемент, соответствующий порядковому номеру 25, был открыт К. В. Шееле в 1774 г. при исследовании минерала пиролюзита. Новый металл был назван магнсзиумом, однако когда в 1888 г. X. Дэви открыл магний и тоже назвал его магнезиум, то во избежание путаницы марганец назвали манганум.
Чистый марганец получают электролизом его хлорида или сульфата, а также методом алюминотермии:

Восстановлением марганца из его оксидов углем получают так называемый ферромарганец, характеризующийся высоким содержанием углерода и железа (70—90% Мп).
Свойства марганца и его соединений. По внешнему виду марганец напоминает железо, но в отличие от него намного тверже и более хрупок. Он образует четыре модификации: до температуры 727 °C существует а-Мп; выше ее — р-Mn, переходящий при 110ГС в y-Mn, а при 1137 °C — в 5-Мп, который устойчив до температуры плавления.
Марганец относится к активным металлам. Обычно он покрыт прочной пленкой оксида, которая предохраняет металл от дальнейшего окисления. В мелко измельченном состоянии марганец легко взаимодействует с кислородом, окисляясь до Мп02. Он активно взаимодействует с галогенами, азотом, углеродом, фосфором и кремнием. Реакция присоединения галогенов и азота сопровождается горением: 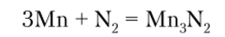
В ряду стандартных электродных потенциалов марганец располагается между алюминием и цинком, поэтому способен активно вытеснять водород из соединений. Порошкообразный марганец при нагревании вытесняет водород из воды:

Образующийся Мп (ОН)2 вследствие очень плохой растворимости замедляет реакцию.
С разбавленными кислотами (кроме HNO,) марганец легко вытесняет водород, окисляясь до Мп (Н):

При нагревании концентрированные серная и азотная кислоты окисляют марганец до Мп (И): 
На холоде эти кислоты пассивируют металл.
Соединения марганца в зависимости от степени окисления имеют следующую стереохимию:
Мп (П) — (/'-конфигурация Мп (Ш) — (/'-конфигурация Mn (IV) — (/^конфигурация. | Октаэдрические структуры, например [Мп (Н20)6]2 [МпС16]2; |
Mn (V) — (/^конфигурация Mn (Vl) — (/'-конфигурация Мп (УП) — (/" -конфигурация. | Тетраэдрические структуры, например МпО2', МпО,. |
Высшая степень окисления марганца +7 соответствует общему числу 3d- и 4х-электронов и характерна лишь в оксосоединениях типа MnOj, Мп207 и Мп03Е Соединения марганца следует рассматривать как производные соответствующих оксидов. Известны следующие оксиды марганца: оксид марганца (П) МпО (зеленого цвета); оксид марганца (Ш) Мп203 (черного цвета); оксид марганца (1У) Мп02, (черно-бурого цвета); оксид марганца (УИ) Мп207 (фиолетового цвета).
Оксид, отвечающий формуле Мп304, представляет соединение смешанного состава — 2МпО и Мп02.
Оксид МпО практически нерастворим в воде. Этот оксид можно получить восстановлением высших оксидов:

Будучи основным оксидом, МпО легко растворяется в кислотах с образованием катионных аквакомплексов:

Соответствующий данному оксиду гидроксид Мп (ОН)2 может быть получен действием растворов щелочей на соли Мп (П). Мп (ОН)2 выделяется из раствора в виде белого рыхлого осадка, который из-за неустойчивости уже на воздухе окисляется:

Мп (ОН)2 является основанием и легко взаимодействует с кислотами с образованием катионных комплексов [Мп (Н20)б]2+. Несмотря на преимущественно основный характер, МпО и Мп (ОН)2 могут при сильном и длительном нагревании взаимодействовать со щелочами:

Таким образом, для двухвалентного марганца характерно координационное число 6, что соответствует октаэдрическим структурам.
+2.
Из анионных комплексов Мп в свободном состоянии выделены K4[Mn (OH)6], Ba2[Mn (OH)G] и ряд других. Эти соединения в водных растворах неустойчивы и полностью разрушаются. Этим можно объяснить, что пи МпО, ни Мп (ОН)2 при обычных условиях не взаимодействуют со щелочами.
Большинство солей Мп (Н) хорошо растворимы (за исключением MnS, MnF2, Mn3(PC)4)2, MnC03) в воде. Диссоциируя, эти соединения образуют аквакомплексы, которым в кристаллическом состоянии соответствуют кристаллогидраты, содержащие обычно шесть молекул Н20. Если же число молекул воды меньше, то роль лигандов кроме Н70 играют и анионные составляющие (рис. 7.1).

Рис. 7.1. Структура кристаллогидратов хлорида марганца (Н).
Помимо аквакомплексов известны и аммиакаты, например [Mn (NH3)6]Cl2, которые очень неустойчивы и легко разрушаются водой с образованием Мп (ОН)2:

Соединения Мп (П) могут проявлять кислотные функции при взаимодействии с однотипными производными щелочных металлов. Так, нерастворимый в воде Mn (CN)2 вследствие комплексообразования взаимодействует с KCN:

Соединения Мп (И) в присутствии окислителей проявляют восстановительные свойства. Так, в силыющелочной среде Мп (П) окисляется до Mn (VI): 
Под действием более сильных окислителей происходит переход Мп (Н) в Mn (VlI):

Данная реакция является качественной. Ион марганца (Н) обнаруживается по появлению характерного малиново-фиолетового окрашивания перманганат-иона.
Оксид марганца (Ш) Мп2Оэ встречается в виде минерала браунита. Соединения Мп (Ш) в растворе можно получить электролитическим или персульфатным окислением Мп (П), а также восстановлением Мп04:

В слабокислых растворах у Мп (Ш) выражена тенденция к гидролизу и диспропорционированию:

Комплексные соединения Мп (Ш), например CsMn (S04)2— 12Н20, более устойчивы, чем соединения Мп (П).
Оксид марганца (1У) Мп02 — наиболее важное соединение Mn (lV). Он представляет собой твердое вещество, нерастворимое в обычных условиях в воде. Мп02 — самый устойчивый из всех оксидов марганца и по своим свойствам является амфотерным оксидом. Взаимодействие со щелочами или основными оксидами приводит к образованию манганитов:

На холоде Мп03 не реагирует с большинством кислот, а при нагревании действует как окислитель:

В реакциях с более сильными окислителями Мп02 проявляет восстановительные свойства: Mn (IV) переходит в Mn (VI) или Mn (VII):

Гидроксид Мп (ОН)4, как и Мп02, обладает амфотерными свойствами, поэтому при взаимодействии с кислотами образует весьма нестойкие соли тина MnCl4, Mn (S04)2. При взаимодействии со щелочами образуются оксоманганаты (манганиты):

Ортои мета-кислоты Н4Мп04 и Н2Мп03 соответствующие Мп (ОН)4, в свободном состоянии не получены. Соли же этих кислот — манганиты — весьма разнообразны, но составу.
Соединения Mn (VI) немногочислены. Из них наиболее устойчивым является манганат-ион Мп04", образующийся при сплавлении Мп02 со щелочами в присутствии окислителей: 
МпО2 устойчив только в сильнощелочной среде. В кислых, нейтральных или слабощелочных растворах происходит диспропорционирование:

Этим и можно объяснить, что соответствующая кислота Н-^Ми^О не существует.
Манганат-ион обладает окислительными свойствами, особенно в кислой среде:

В присутствии же более сильных окислителей происходит окисление до перманганата:

Оксид марганца (УН) Мп207 получают действием концентрированной H2S04 на перманганаты:

Будучи неустойчивым соединением, Мп., 07 разлагается со взрывом при нагревании, что указывает на сильные окислительные свойства:

Многие горючие вещества (спирт, эфир и др.) воспламеняются при соприкосновении с Мп207.
С водой на холоде Мп207 реагирует без разложения, образуя марганцовую кислоту НМп04. Эта кислота относится к сильным кислотам и может существовать в водных растворах в концентрациях не выше 20% (на холоде). Соли этой кислоты — перманганаты. Ион Мп04 имеет интенсивную малиново-фиолетовую окраску, а кристаллические перманганаты кажутся почти черными. Растворы перманганата неустойчивы и медленно разлагаются. Процесс ускоряется в присутствии кислоты:

В нейтральных или слабощелочных растворах в отсутствие света разложение протекает очень медленно, что учитывают в аналитической химии при приготовлении стандартных растворов.
При нагревании перманганаты разлагаются с выделением 02:

что находит применение в лабораторной практике для получения кислорода.
Все перманганаты являются энергичными окислителями. Степень вос;
+7.
становления Мп зависит от pH среды.
Наиболее сильные свойства окислителя перманганат-ион проявляет в кислой среде восстанавливаясь до Мп2+:

В нейтральной среде выпадает в осадок оксид марганца (1У).
В щелочной среде окислительные свойства Мп04 выражены намного слабее, в результате реакции образуется манганат-ион MnOf :

но в крепких щелочах при избытке МпО~ образуется манганит-ион МпО|".
Ниже приведены уравнения окислительно-восстановительных реакций с участием Мп04:

В кислой среде образуются катионные комплексы типа [Мп (Н20)6]2+.
Перманганат-ион окисляет и многие органические соединения — в кислой среде спирты окисляются до альдегидов:

Сопоставляя свойства оксидов марганца, можно сделать следующие обобщения.
Свойства оксидов марганца зависят от степени окисления металла: с увеличением степени окисления усиливаются кислотные свойства:

Окислительные или восстановительные свойства оксидов находятся также в зависимости от степени окисления металла: высшие оксиды — окислители и восстанавливаются до Мп02; низшие оксиды — восстановители, окисляясь, образуют Мп02. Таким образом, Мп02 — самый устойчивый оксид.
В полном соответствии со свойствами оксидов находятся свойства гидроксидов:

Из элементов 7-й группы только марганец является биогенным элементом и одним из десяти металлов жизни, необходимых для нормального протекания процессов в живых организмах.
КМп04 из всех солей марганцовой кислоты самая распространенная. Перманганат калия (калия перманганат) очень широко применяется как окислитель. Разбавленные растворы применяются в медицинской практике наружно как дезинфицирующее средство.
Под действием калия перманганата КМп04 белки окисляются и свертываются (коагулируют). На этом основано его применение в качестве наружного препарата, обладающего противомикробными и прижигающими свойствами. При этом его действие проявляется только на поверхности кожи и слизистых оболочек. Окислительные свойства водного раствора КМп04 используют для обезвреживания токсичных органических веществ. В результате окисления образуются менее токсичные продукты. Например, наркотик морфин превращается в биологически малоактивный оксиморфин.
Калия перманганат применяют в титриметрическом анализе для определения содержания различных восстановителей (перманганатометрия).
Высокую окислительную способность перманганата используют в экологии для оценки загрязненности сточных вод (нерманганатный метод). По количеству окисленного (обесцвеченного) перманганата определяют содержание органических примесей в воде.
Перманганатометрию используют также в клинических лабораториях для определения содержания мочевой кислоты в крови.