Углерод.
Химия элементов

Углерод может проявлять степень окисления +4, +2 и -4. От остальных элементов группы он отличается тем, что число валентных электронов в его атоме равно числу валентных орбиталей. Наряду со способностью образовывать ковалентные связи с другими элементами углерод обладает исключительным свойством, заключающимся в том, что его атомы способны соединяться между собой практически в бесконечном числе… Читать ещё >
Углерод. Химия элементов (реферат, курсовая, диплом, контрольная)
Историческая справка Углерод — один из тех немногочисленных элементов, который известен с древних времен. Имя первооткрывателя углерода неизвестно. Также неизвестно, какая из форм элементарного углерода — алмаз или графит — была открыта раньше.
Среди всех элементов углерод занимает особое положение, так как он расположен между электроположительными элементами, находящимися в левой части, и электроотрицательными элементами, находящимися в правой части периодической таблицы Д. И. Менделеева. В возбужденном атоме углерода одна 5- и три р-орбитали не существуют в чистом виде, а образуют четыре гибридизированных, одинаковых по форме, но имеющих различное пространственное расположение орбитали.
В зависимости от числа a-связей координационное число углерода равно 4 (^-гибридизация), 3 (.^-гибридизация) или 2 (sp-гибридизация валентных орбиталей). При зр3-гибридизации характерно тетраэдрическое пространственное расположение a-связей, $р2-гибридизации — треугольное, а sp-гибридизации — линейное.
Углерод может проявлять степень окисления +4, +2 и -4. От остальных элементов группы он отличается тем, что число валентных электронов в его атоме равно числу валентных орбиталей. Наряду со способностью образовывать ковалентные связи с другими элементами углерод обладает исключительным свойством, заключающимся в том, что его атомы способны соединяться между собой практически в бесконечном числе, образуя разнообразные гомоцепи. Такие молекулы, в которых атомы углерода образуют гомоцепи С—С, бывают линейные, разветвленные, циклические, сшитые.
Свойства углерода и его соединений. Все простые вещества углерода имеют полимерное строение. В двухатомной молекуле С2 атомы связаны посредством двух связей, причем эти связи менее прочны, чем две а-связи в гомоцеиях.
Исходя из гибридных состояний орбиталей атомы углерода могут образовывать полимерные структуры координационного, слоистого и линейного типов, которым соответственно отвечают sp3-, sp2- и sp-гибридные состояния орбиталей.
Алмаз — бесцветное, прозрачное вещество, не проводящее электрический ток. Имеет кубическую элементарную ячейку. Все атомы эквивалентны, и каждый окружен правильным тетраэдром из четырех других, поскольку имеет место $р3-гибридизация. Координационное число решетки алмаза равно 4. Все атомы углерода в кристаллической решетке расположены друг от друга на одинаковом расстоянии 0,154 нм. Каждый атом углерода образует локализованные двухэлектронные связи с соседними атомами. Такая структура объясняет чрезвычайно высокую твердость алмаза.
Графит — темно-серое, непрозрачное, со слабым металлическим блеском, мягкое, слабо проводящее электрический ток вещество. Кристаллическая решетка графита, структура которой показана на рис. 13.1, существен;
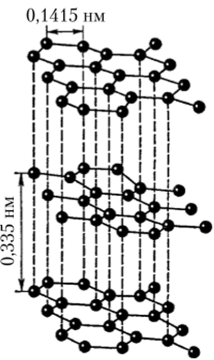
Рис. 13.1. Структура графита, но отличается от решетки алмаза: она состоит из бесконечных плоских параллельных слоев, образованных из шестичленных колец.
Поскольку для атомов углерода в графите характерна луг-гибридизация, то они образуют макромолекулу С2со. Это гибридное состояние стабилизируется делокализованной л-связыо, образовавшейся за счет четвертого электрона каждого из атомов С макромолекулы. Такая особенность структуры графита определяет его электрическую проводимость.
В 1960;х гг. отечетвенные химики В. В. Коршак, А. М. Сладков, Б. И. Касаточкин и Ю. II. Кудрявцев синтезировали новое аллотропное видоизменение углерода, названное карбином. Карбин — линейный полимер углерода. Исследования структуры карбина показали, что атомы углерода в нем связаны чередующимися тройными и одинарными связями:

Карбин позднее был найден в природе.
Многие формы аморфного углерода — древесный уголь, сажа и ламповая копоть — в действительности представляют собой микрокристаллические формы графита.
Еще одной аллотропной модификацией углерода является фуллерсн, в котором атомы расположены в вершинах правильных шестии пятиугольников, покрывающих поверхность сферы или сфероида. Такие молекулы могут содержать 28, 32, 50, 60, 70, 76 и т. д. атомов углерода. Фулерены были открыты в 1985 г. и названы по имени американского архитектора Б. Фуллера, который применял при конструировании куполов зданий структуры, подобные структуре фуллерена (рис. 13.2).
В 2010 г. А. К. Гейму и К. С. Новосёлову была присуждена Нобелевская премия за опыты с новой модификацией углерода — графеном. Графен — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, находящихся в-гибридизации и соединенных в гексагональную двумерную кристаллическую решетку. Его можно представить как одну плоскость графита, отделенную от кристалла (рис. 13.3).

Рис. 13.2. Структура фулерена.
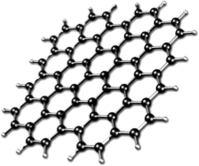
Рис. 13.3. Структура графена.
В химическом отношении углерод чрезвычайно инертен. Его реакционная способность усиливается с повышением температуры.
При нагревании на воздухе углерод энергично взаимодействует с кислородом. При недостатке кислорода образуется монооксид углерода (угарный газ) СО: 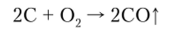
При избытке кислорода образуется диоксид углерода С02:

Под воздействием высоких температур углерод способен взаимодействовать и с металлами, образуя карбиды металлов:
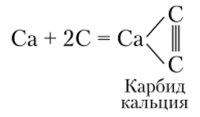
При температуре электрической дуги углерод соединяется с водородом, образуя метан:
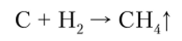
Углерод взаимодействует и со сложными веществами. Так, при пропускании водяных паров через раскаленный уголь или кокс получается смесь оксида углерода и водорода, называемая водяным газом:

Эта смесь широко применяется в качестве газообразного топлива. Образование водяного газа протекает при температуре выше 1200 °C. Ниже этой температуры реакция протекает в другом направлении:
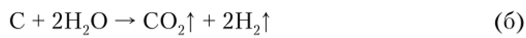
Реакции (а) и (б) лежат в основе конверсионного способа получения водорода.
При высоких температурах углерод способен восстанавливать многие металлы из их оксидов. На этом основано получение металлов из их кислородных руд (см. гл. 14).
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до диоксида углерода:
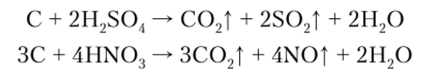
Карбиды получаются при непосредственном взаимодействии углерода с металлами или оксидами металлов. Поскольку для углерода характерно образование гомоцепей, то состав большинства карбидов не отвечает степени окисления углерода -4. По характеру химической связи различают ковалентные, ионно-ковалентные и металлические карбиды.
Простейшим ковалентным карбидом можно считать метан СН4, молекула которого имеет тетраэдрическое строение. Метан — родоначальник органических соединений — углеводородов.
Кремний и бор образуют ковалентные полимерные карбиды SiC и В4С, которые обладают высокой твердостью и химически инертны. Ионно-ковалентные карбиды — это бесцветные кристаллические солеподобные вещества, образованные металлами. Взаимодействуя с водой, такие карбиды разлагаются с образованием углеводородов, поэтому их рассматривают в качестве производных соответствующих углеводородов:

Ацетилениды наиболее характерны для 5-элементов 1-й и 2-й групп и d-элементов 11-й и 12-й групп, а также для алюминия.
Переходные металлы образуют карбиды — фазы внедрения, в которых атомы углерода занимают октаэдрические пустоты в плотной упаковке атома металла. Обычно они представляют собой тугоплавкие вещества, обладающие электрической проводимостью. Металлы с малыми атомными радиусами (Cr, Mn, Fe, Со и Ni) образуют карбиды состава Ме3С, по свойствам занимающие промежуточное положение между типичными ионными карбидами и карбидами — фазами внедрения. Они гидролизуются водой и разбавленными кислотами.
В галогенидах углерод проявляет степень окисления +4. В соответствии с 5/?3-гибридным состоянием валентных орбиталей углерода молекулы СНа14 имеют тетраэдрическую структуру. В ряду CF4 — СС14 — СВг4 — С14 агрегатные состояния изменяются от газообразного (CF4) к твердому (СВг4 и С14) через жидкое (СС14). CF4 и СС14 — бесцветные вещества, СВг4 — бледно-желтое, а С14 — светло-красное вещество. Все соединения углерода с галогенами — нерастворимые в воде соединения, но легко растворимые в органических растворителях.
Гидролиз этих соединений протекает лишь при высоких температурах. Устойчивость к гидролизу при обычных условиях объясняется кинетическим фактором: атом углерода координационно насыщен и не может присоединять молекулы Н20 для инициирования гидролиза.
CF4 обычно получают непосредственной реакцией между простыми веществами или реакцией обмена между СС14 и AgF при 300°С:
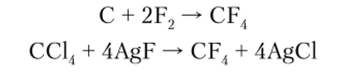
СС14 образуется при хлорировании сероуглерода CS2:
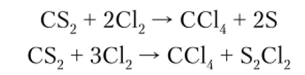
Из галогенидов наибольшее применение имеет СС14, представляющий собой бесцветную, прозрачную жидкость, обладающую сладковатым запахом с Гкип = +76,7°С, химически инертную. Не горит, поэтому находит широкое применение в изготовлении огнетушителей.
Смешанный фторид-хлорид углерода (дифтордихлорметан) — фреон CF2C12 используется в качестве хладоагента в холодильных установках (Гкип = -30°С). '.
Оксид углерода (ГУ) С02 имеет линейную структуру, и связи в ней образуются за счет четырех электронных пар на четырех трехцеитровых орбиталях. Согласно теории локализованных связей это отвечает расположению четырех электронных пар на четырех двухцентровых орбиталях: 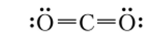
СО., (углекислый газ) — продукт полного сгорания углерода. Он также образуется при термическом разложении карбонатов. В промышленности СО, получают при обжиге известняка:
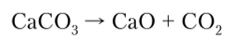
В лаборатории его можно получить действием разбавленных кислот на карбонаты:
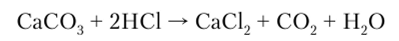
При обычных условиях СО, — бесцветный газ, в 1,5 раза тяжелее воздуха. Растворим в воде (при 0 °C 1,7 л С02 в 1 л Н, 0).
При сильном охлаждении С02 кристаллизуется в виде белой снегообразной массы, которая в спрессованном виде испаряется очень медленно, сильно понижая температуру окружающей среды. Этим и объясняется ее применение в качестве сухого льда. Не поддерживает горения и дыхания.
При высоких температурах углекислый газ может реагировать с металлами, сродство которых к кислороду выше, чем у самого углерода:
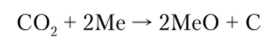
При растворении С02 в воде происходит их частичное взаимодействие, ведущее к образованию угольной кислоты Н2С03.
Гидратация С02 водой происходит в две ступени. При pH < 8 основным механизмом является прямая гидратация С02.

При pH > 10 преобладает прямая реакция С02 с ионом ОН :
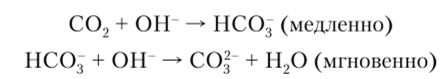
Угольная кислота Н2С03 — очень слабая и незначительно диссоциирует на ионы. Поэтому водные растворы СО обладают слабокислыми свойствами:

Структурная формула угольной кислоты.
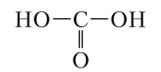
Как двухосновная кислота она образует два типа солей: средние соли — карбонаты; кислые соли — гидрокарбонаты. Из карбонатов растворимы только Na2C03, К2С03, Rb2C03, Cs2C03 и (NH4)2C03, гидрокарбонаты же в воде легко растворимы, за исключением NaHCO;). Карбонаты и гидрокарбонаты могут быть получены взаимодействием СО, с растворами оснований или же путем обменных реакций:
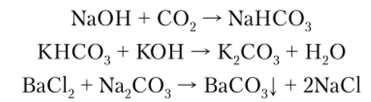
При сильном нагревании карбонаты щелочных металлов плавятся, не разлагаясь, а остальные карбонаты при нагревании легко разлагаются на оксид соответствующего металла и С02:

Гидрокарбонаты при нагревании переходят в карбонаты:

Растворы карбонатов щелочных металлов в водных растворах имеют сильнощелочную реакцию вследствие гидролиза:
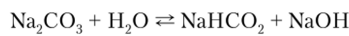
Качественной реакцией на карбонат-ион СОи гидрокарбонат-ион НСО является их взаимодействие с более сильными кислотами. Выделение с характерным шипением диоксида углерода указывает на наличие этих ионов. Пропуская выделяющийся С02 через известковую воду, можно наблюдать помутнение раствора вследствие образования карбоната кальция:
Из производных угольной кислоты важное значение имеют полный и неполный амиды, которые изучаются в органической химии (рис. 13.4).

Рис. 13.4. Амиды угольной кислоты.
Дихлорангидрид угольной кислоты СОС12 — фосген, хлористый карбонил. Широко применяется в органическом синтезе. Чрезвычайно ядовит!
Оксид углерода (Н) СО является гетероядерной двухатомной молекулой, строение которой рассмотрено в гл. 4.
Экспериментальные данные показывают, что между строением СО и N2 имеется большое сходство, выражающееся в очень близких значениях энергии связи, а также межатомных расстояниях. В СО это расстояние равно 0,113 им. Все эти данные подтверждают структуру с тройной связью для СО:
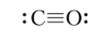
В химическом отношении СО — сравнительно инертное соединение. При повышении температуры до 20(ГС и давлении 15−10:> Па СО реагирует с NaOH, образуя натриевую соль муравьиной кислоты: 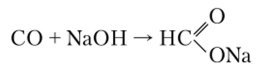
При нагревании до 700 °C СО окисляется до С02:
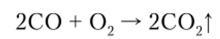
При взаимодействии с парами воды СО образует С02 и Н2:
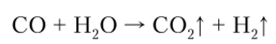
СО — энергичный восстановитель. Он восстанавливает многие металлы из их оксидов, что используется в металлургии при получении металлов из их кислородных руд:
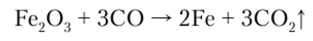
Одна из важнейших особенностей СО — способность проявлять свойства лиганда, но отношению к переходным металлам. За счет несвязывающей электронной пары углерода СО проявляет а-донорные свойства, а за счет разрыхляющих л|)азр-орбиталей — л-акцепторные свойства. Связь металл—СО является кратной. Эти комплексы получили название карбонилов металлов. Среди них различают моноядерные карбонилы Ме (СО)г, иолиядерные карбонилы, содержащие два центральных атома и более, и карбонилгидриды металлов. Первая группа — моноядерные карбонилы — гидрофобные и летучие вещества, растворимые в неполярных растворителях. Для них характерно октаэдрическое — Сг (СО)6, Мо (СО)6, григонально бипирамидальное — Fe (CO)5 и тетраэдрическое — Ni (CO)4 строение.
Обширную группу составляют иолиядерные карбонилы, которые могут быть гомоядерными, например Fe3(CO)p, или гетероядерными, например MnRe (CO)10. В этих соединениях кроме линейных фрагментов Me—С—О могут существовать или связи Me—Me, или, в дополнение к ним, еще и мостиковые карбонильные группы (рис. 13.5).
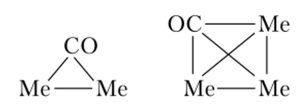
Рис. 13.5. Иолиядерные карбонилы.
Чем больше радиус атома металла в таких карбонилах, тем предпочтительней становится структура без мостиковых групп.
Гидриды, соответствующие карбопилат-анионам, называют карбонилгидридами. Они малоустойчивы и трудно выделяются.
Карбонилы металлов получают различными способами.
Так, Ni (CO)4 и Fe (CO)5 можно получить непосредственным взаимодействием металла в мелкодисперсном состоянии с СО.
Более общий метод получения карбонилов — восстановление металлов из их соединений в присутствии СО:
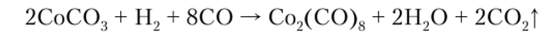
Сероуглерод CS2 (S=C=S) — летучая, бесцветная, очень ядовитая жидкость. В химическом отношении весьма активен и является эндотермическим соединением. Он легко окисляется, а при нагревании воспламеняется: 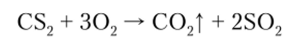
CS, вступает в реакции комплексообразования. При этом он может связываться как донор через атом серы или же присоединяться по окислительному типу.
Важнейшей реакцией CS2 является нуклеофильное присоединение к углеродному атому молекулы ионов SH в щелочной среде, что приводит к образованию тиокарбонатов:
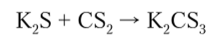
Синильная кислота HCN — чрезвычайно ядовитое газообразное вещество. Как и галогеноводороды, представляет собой ковалентное молекулярное соединение, способное смешиваться с водой в любых соотношениях. Водный раствор имеет слабокислую реакцию и называется циановодородной кислотой (К = 7,9−10 10).
HCN имеет линейную структуру, которой соответствует таутомерная форма — изоцианид водорода:
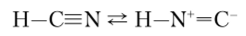
Соли HCN (цианиды) сильно гидролизованы. Цианиды обладают восстановительными свойствами. Окисляясь, они переходят в цианаты:
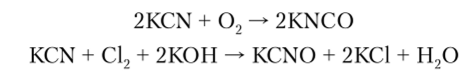
Если растворы цианидов нагревать в присутствии серы, то образуются соданиды (тиоцианаты):
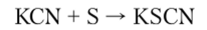
Синильная кислота получается взаимодействием СО и NH3 под давлением в присутствии катализаторов:
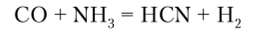
Цианиды же получают сплавлением цианамида кальция CaCN., с углем и Na2C03 или же из амидов:
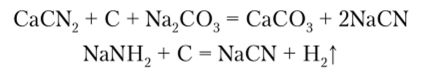
Цианид-ион имеет большое значение как лиганд. Образование цианистых комплексов почти полностью ограничено ri-переходными металлами, а также цинком, кадмием и ртутью. В определении устойчивости этих комплексов важную роль играет л-связывание металл — CN.
Большинство цианидных комплексов имеет общую формулу |Me" +(CN)V](V п) и является анионами, например |Fe (CN)f;|1, [Ni (CN)6]2 .
Биологическая роль углерода. По содержанию в организме человека (21%) углерод относится к макроэлементам. Он входит в состав всех тканей и клеток в форме белков, жиров, углеводов, гормонов, витаминов.
В медицинской практике находит применение уголь активированный, который используют как адсорбирующее и детоксицирующее средство при диспепсии, метеоризме, пищевых интоксикациях. Натрия гидрокарбонат (NaHC03) применяют внутрь как антацидное средство при повышенной кислотности желудочного сока, наружно как антисептическое средство в водных растворах для полосканий, промываний, при ожогах.