Механизм буферного действия

В основе расчета pH буферных систем лежит закон действующих масс для кислотно-основного равновесия. Для буферной системы 1-го типа, например ацетатной, концентрацию ионов Н+ в растворе легко вычислить, исходя из константы кислотно-основного равновесия уксусной кислоты: Уменьшение концентрации анионов СН3СОО уравновешивается повышением концентрации молекул СН3СООН. В результате происходит… Читать ещё >
Механизм буферного действия (реферат, курсовая, диплом, контрольная)
Механизм буферного действия можно понять на примере ацетатной буферной системы CH3COONa/CH3COOH, в основе действия которой лежит кислотно-основное равновесие:

Главный источник ацетат-ионов — соль натрия ацетата CH3COONa, сильный электролит: 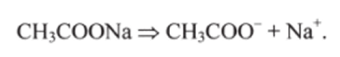
При добавлении щелочи NaOH протоны уксусной кислоты (резервная кислотность) высвобождаются и нейтрализуют добавочные ионы ОН-, связывая их в молекулы воды: 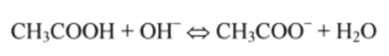
(кислотно-основное равновесие смещается вправо, по Ле Шателье). В этом случае также происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а следовательно, и незначительное изменение pH. Уменьшение концентрации слабой кислоты СН3СООН точно уравновешивается повышением концентрации анионов СН3СОО .
При добавлении сильной кислоты сопряженное основание СН3СОО связывает добавочные ионы Н+, превращаясь в слабую уксусную кислоту:
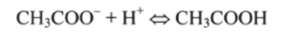
(кислотно-основное равновесие смещается влево, по Ле Шателье).
Уменьшение концентрации анионов СН3СОО уравновешивается повышением концентрации молекул СН3СООН. В результате происходит небольшое изменение в соотношении концентраций слабой кислоты и ее соли, а следовательно, и незначительно изменяется pH.
Аналогичен механизм действия и других буферных систем. Например, для белкового буферного раствора, образованного кислой и солевой формами белка, при добавлении сильной кислоты ионы Н* связываются солевой формой белка:
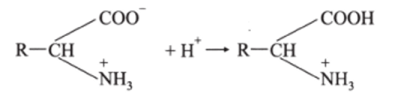
Количество слабой кислоты при этом незначительно увеличивается, а солевой формы белка эквивалентно уменьшается. Поэтому pH остается практически постоянным.
При добавлении щелочи к этому буферному раствору ионы Н связанные в «белке-кислоте», высвобождаются и нейтрализуют добавленные ионы ОН :
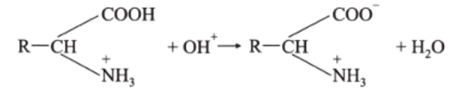
Количество солевой формы белка при этом незначительно увеличивается, а «белка-кислоты» эквивалентно уменьшается. И поэтому pH практически не меняется.
Таким образом, рассмотренные системы показывают, что буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с образованием малодиссоциированных продуктов.
В основе расчета pH буферных систем лежит закон действующих масс для кислотно-основного равновесия. Для буферной системы 1-го типа, например ацетатной, концентрацию ионов Н+ в растворе легко вычислить, исходя из константы кислотно-основного равновесия уксусной кислоты:
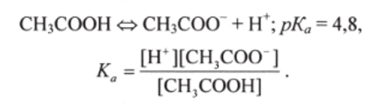
Отсюда следует, что концентрация водород-ионов равна 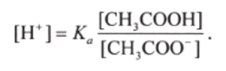
В присутствии второго компонента буферного раствора — сильного электролита CbbCOONa — кислотно-основное равновесие уксусной кислоты СНзСООН сдвинуто влево (принцип Ле Шателье). Поэтому концентрация недиссоциированных молекул СНзСООН практически равна концентрации кислоты, а ионов СН3СОО — концентрации соли. В таком случае уравнение для концентрации Н+ принимает следующий вид: 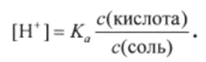
Для буферной системы 2-го типа, например аммиачной, концентрацию ионов Н в растворе можно рассчитать, исходя из константы кислотно-основного равновесия сопряженной кислоты NHV.
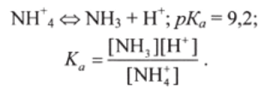
Отсюда, логарифмируя, получают уравнение Гендерсона-Гассельбаха для буферных систем 2-го типа: 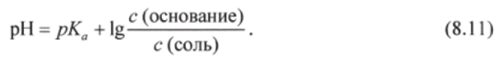
Значения pH буферных растворов других типов также можно рассчитывать по уравнениям буферного действия. Например, для фосфатной буферной системы НР04 /Н2Р04, относящейся к 3-му типу, pH можно рассчитывать по уравнению (8.11): 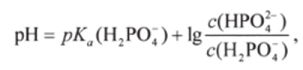
где pKJ, Н, РО") — отрицательный десятичный логарифм константы диссоциации фосфорной кислоты по второй ступени (Н2РО~ - слабая кислота); с (НР04") и с (Н2РО~) — соответственно концентрации соли и кислоты.
Уравнение Гендерсона-Гассельбаха позволяет сформулировать ряд важных выводов.
1. pH буферных растворов зависит от отрицательного десятичного логарифма константы диссоциации слабой кислоты рКа или основания рКь и от отношения концентраций компонентов КО-пары, но практически не зависит от разбавления раствора водой.
Следует отметить, что постоянство pH хорошо выполняется при малых концентрациях буферных растворов. При концентрациях компонентов выше 0,1 моль/л необходимо учитывать коэффициенты активности ионов системы.
2. Значение рКа любой кислоты и рКь, любого основания можно вычислить по измеренному pH раствора, если известны молярные концентрации компонентов.
Пример 1. Вычислить рКа молочной кислоты, если pH раствора, в 1 л которого содержится 0,01 моль молочной кислоты и 0,0139 моль лактат-иона (анион молочной кислоты), равен 4,0.
В соответствии с уравнением Гендерсона-Гассельбаха (8.11).
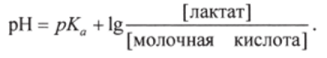
Отсюда.
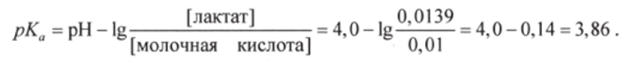
Кроме того, уравнение Гендерсона-Гассельбаха позволяет рассчитать pH буферного раствора, если известны значение рКа и молярные концентрации компонентов.
3. Уравнение Гендерсона-Гассельбаха можно использовать и для того, чтобы узнать, в каком соотношении нужно взять компоненты буферной смеси, чтобы приготовить раствор с заданным значением pH.
Пример 2. Вычислить соотношение концентраций CHjCOONa и СН3СООН в буферном растворе, чтобы pH равнялся 5,8 (рКл для СН3СООН равен 4,8). В соответствии с уравнением Гендерсона-Гассельбаха (8.11).
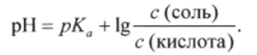
Отсюда.
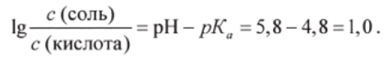
Тогда 
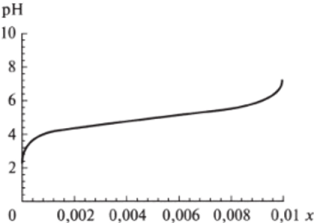
Рис. 8.4. Теоретическая кривая титрования уксусной кислоты (.г — концентрация добавленной щелочи).
4. Уравнение Гендерсона-Гассельбаха можно использовать для расчета теоретической кривой титрования. При титровании кислоты щелочью с (соль) равна концентрации добавленной щелочи х, а с (кислота) равна соответственно со (кислота) -х. Подставляя эти значения в уравнение Гендерсона-Гассельбаха, получают удобную для оценки буферных возможностей системы теоретическую кривую титрования (рис. 8.4).