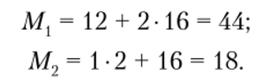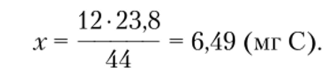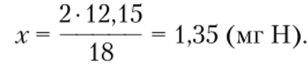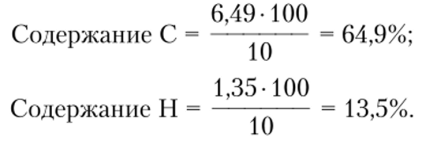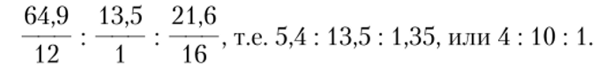I. Нахождение химической формулы вещества по массовым долям элементов. При сжигании органического соединения весь содержащийся в нем углерод переходит в С02, а весь водород — в Н20. Следовательно, определение количества СО., и Н20 показывает относительное содержание углерода и водорода в соединении.
Например, известно, что при сгорании 10 мг органического вещества, состоящего из С, Н и, возможно, О, выделилось 23,8 мг СО., и 12,15 мг Н20. Используя эти данные, можно вывести эмпирическую формулу соединения.
Во-первых, зная содержание С и Н в С02 и Н20, необходимо рассчитать количество этих элементов в анализируемом веществе. Для этого следует вычислить молярные массы С02 (М,) и Н20 (М2):
Далее, исходя из доли С в составе С02, рассчитать содержание С в образце:
12 г С находится в 44 г С02, следовательно,.
х мг С находится в 23,8 мг С02;
Аналогично вычисляется содержание Н в образце:
2 г Н находится в 18 г Н20, следовательно,.
х мг Н находится в 12,15 мг Н20;
Если массу образца 10 мг принять за 100%, тогда относительное содержание в нем С и Н составит, соответственно:
Поскольку единственным другим элементом в соединении является О, то его содержание составляет: 100 — 64,9 — 13,5 = 21,6%.
Для расчета эмпирической формулы необходимо соотношение масс элементов в веществе перевести в соотношение количеств атомов, разделив относительное содержание каждого элемента в соединении на атомную массу этого элемента:
Таким образом, эмпирическая формула анализируемого соединения с1н10о.
II. Вычисление массовой доли элемента в сложном веществе по его формуле. Например, требуется определить массовую долю азота в аминокислоте глицин.
Молекулярная формула глицина (см. табл. 3.1) — C2H502N. Сначала вычисляют относительную молекулярную массу глицина Мглицин сложением относительных атомных масс (А) каждого элемента — углерода (Ас), водорода (Ан), кислорода (А0) и азота (AN), с учетом числа атомов элемента в молекуле. Следовательно, относительная молекулярная масса для глицина рассчитывается по формуле: 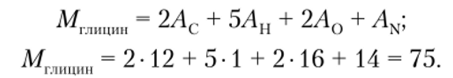
Масса всего соединения составляет 100%, тогда массовая доля азота WK вычисляется из соотношения.
Таким образом, массовая доля азота в аминокислоте глицин составляет 18,67%.