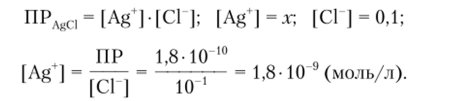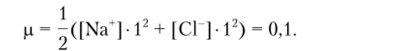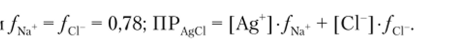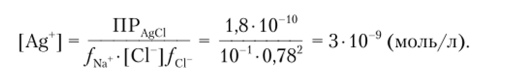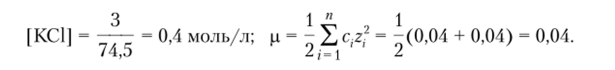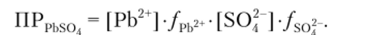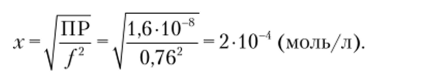На растворимость осадков в гравиметрическом анализе влияют присутствие сильной кислоты, одноименного иона, солевой эффект.
1. Присутствие сильной кислоты увеличивает растворимость осадка. Для простейшего случая растворимость осадка (Р) рассчитывается по формуле 
где [Н+] — концентрация ионов водорода, создаваемая сильной кислотой; ПР — произведение растворимости осадка МеЛп (осадок образован однозарядным катионом и кислотным остатком слабой одноосновной кислоты); КИАп — константа диссоциации слабой кислоты НАп.
Пример 4.2. Вычислим концентрацию [ Ag+] над осадком AgCNS в присутствии 0,03 М HN03 (ПРЛ),СК5 =1,110 |2; Кист = 1,4? 10 ').
Решение. Подставляем значения в приведенную формулу:
2. Присутствие одноименного иона существенно понижает растворимость осадка.
Пример 4.3. Вычислим концентрацию [Ag‘] над осадком AgCl в присутствии 0,1 М раствора NaCl (ПРЛйа = 1,8 -10 10).
Решение. Без учета ионной силы имеем.
С учетом ионной силы: 0,1 н раствор NaCl создает ионную силу.
По справочным даины 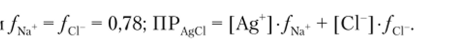
Тогда 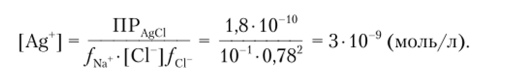
Одноименный ион уменьшает растворимость осадка в 310 ®/(1,8 -10 9).
- 1,7 раза.
- 3. Явление солевого эффекта. Повышение растворимости осадка в присутствии постороннего электролита, создающего ионную силу раствора — проявление солевого эффекта.
Пример 4.4. Вычислим растворимость PbSOf в растворе КС1 (3 г/л) (ПРрь$ 0 = = 1,6−10 й) и сравним его с растворимостью в воде.
Решение. Ионную силу будет создавать раствор КС1:
Величина/зависит от ионной силы раствора и равна/рь2+ =/so2 = 0,76. Произведение растворимости, выраженное через активность, равно.
Обозначим [РЬ2+] = [SO2 | = х. Тогда.
Растворимость в воде: х = Щр = 1,3 * 10 1 моль/л.
Солевой эффект увеличивает растворимость в 2/1,3 ~ 1,54 раза.