Иодометрический анализ.
Аналитическая химия и физико-химические методы анализа

При определении окислителей нужно титровать их раствором KI. Но в таком титровании невозможно фиксировать точку эквивалентности (прекращение образования свободного иода). Поэтому применяют косвенный метод — метод замещения. Окислительный потенциал иода невелик (<�р^/2Г = 0,54 В). Иод является сравнительно слабым окислителем по сравнению с перманганат-ионом (Фмпо1/мп2* = 1,51 В) или дихромат-ионом… Читать ещё >
Иодометрический анализ. Аналитическая химия и физико-химические методы анализа (реферат, курсовая, диплом, контрольная)
Иодометрический анализ основан на процессе.

Окислительный потенциал иода невелик (<�р^/2Г = 0,54 В). Иод является сравнительно слабым окислителем по сравнению с перманганат-ионом (Фмпо1/мп2* = 1,51 В) или дихромат-ионом (Ф<'Г2«2 /2Ср- = 1,33 В).
Наоборот, ионы Г — значительно более сильные восстановители, чем Сг3+ или Мп2+.
Потенциал иода ср^/21 = 0,54 В показывает, что:
- а) все восстановители, имеющие (р°кнсл < 0,54 В, способны окислятся 12;
- б) все окислители, имеющие ф^кнсл > 0,54 В, способны восстанавливаться Г. Иодометрию можно использовать для:
- • определения восстановителей (окисляя их раствором 12),
- • определения окислителей (восстанавливая их ионами I).
При взаимодействии тиосульфата натрия с иодом образуется тетратионат натрия:
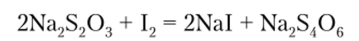
Реакция идет быстро в прямом направлении, так как окислительный потенциал иода много больше окислительного потенциала тетратионат-иона Koi-^ol- = 0−08 В).
С учетом электронных переходов.
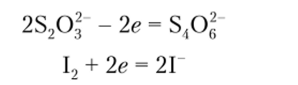
молярные массы эквивалентов тиосульфата натрия и иода равны соответственно.
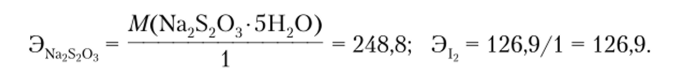
Точку эквивалентности устанавливают с помощью крахмала. Раствор крахмала образует с иодом смешанное комплексно-адсорбционное соединснис интенсивно-синего цвета. При титровании иода тиосульфатом конец реакции устанавливают по обесцвечиванию синего раствора от одной капли Na2S203. Раствор крахмала прибавляют в самом конце титрования, когда иода остается очень мало, и титруемый раствор будет иметь бледную (соломенно-желтую) окраску. Если прибавить крахмал раньше, когда иода в растворе еще много, то образующееся в большом количестве соединение иода с крахмалом будет медленно реагировать с тиосульфатом; поэтому раствор может быть перетитрован.
Зная нормальную концентрацию раствора иода и затраченные на титрование объемы растворов его и тиосульфата, можно рассчитать нормальную концентрацию и титр раствора Na2S203 Наоборот, по известной нормальной концентрации или титру раствора Na2S203 можно подсчитать нормальную концентрацию и титр раствора иода.
Также можно определять кислоты-восстановители: мышьяковистую (H3As03), сернистую (H2S03), сероводородную и их соли, а также SnCl2 и другие восстановители.
Примеры возможных определений восстановителей иодом:
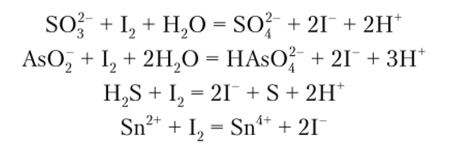
При определении окислителей нужно титровать их раствором KI. Но в таком титровании невозможно фиксировать точку эквивалентности (прекращение образования свободного иода). Поэтому применяют косвенный метод — метод замещения.
К смеси растворов иодида калия и кислоты (взятых в избытке) прибавляют с помощью пипетки точный объем окислителя. При этом окислитель выделяет из KI эквивалентное количество иода (необходимо достаточное время для завершения реакции выделения иода в темноте), который оттитровывают тиосульфатом по схеме.
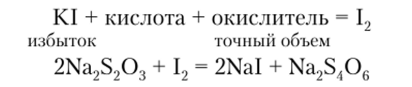
По этой схеме можно определять многие окислители, способные окислять ионы 2 Г в 12. Это С12, Вг2, КМп04, КСЮ3, СаОС12 (белильная известь), Н202, нитриты, Fe (III), Cu (II) и др.
Примеры возможных определений окислителей: 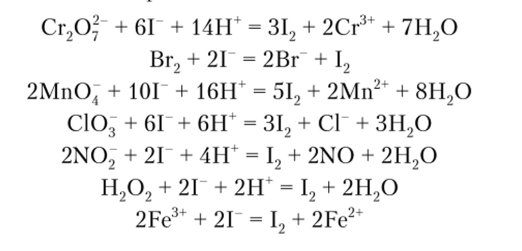
Наименьшая концентрация иода, которую можно обнаружить в присутствии крахмала, — 10 6—2−10 J н (при избытке крахмала).
Так как окислительный потенциал иода невелик, то многие иодометрические реакции обратимы и доходят до конца только при создании определенных условий.
1. Титрование ведут на холоде, так как 12 летуч, а также с повышением температуры понижается чувствительность крахмала как индикатора.
2. Титрование нельзя проводить в сильнощелочной среде, так как 12 реагирует со щелочами: 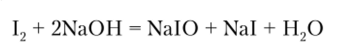
Ионы гипоиодита (Ю) являются более сильными окислителями, чем 12, они окисляют тиосульфат частично до сульфата:
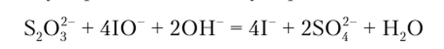
Чем больше [ОН ] в растворе, тем большее количество тиосульфата превращается в сульфат, pH раствора не должен превышать 9.
Избыток ионов |Н+] связывают прибавлением NallCO:
pH ~ 8 не мешает титрованию. 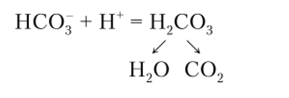
3. Необходимо применять избыток KI. Это способствует растворению выделяющегося 12: 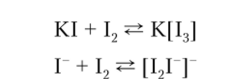
- (по мере титрования реакция сдвигается влево), избыток KI ускоряет реакцию между I и окислителем.
- 4. К титрованию 12 приступают, но истечении некоторого времени.
- 5. Свет ускоряет побочную реакцию:
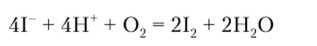
Анализируемый раствор с выделяющимся иодом выстаивают в темноте в течение 5 мин.