Общие закономерности химических процессов

Само понятие «стандартные условия» предполагает введение произвольных значений параметров, которые должны быть удобными для применения. Поскольку области параметров, с которыми приходится иметь дело в современных науке и технике, весьма широки, в приведенном описании стандартных условий учтены только наиболее часто используемые характеристики. С детальным описанием выбора стандартного состояния… Читать ещё >
Общие закономерности химических процессов (реферат, курсовая, диплом, контрольная)
ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
После усвоения материала главы 10 студент должен: знать
- • основные понятия и законы химической термодинамики;
- • типы термодинамических систем;
- • параметры и функции состояния термодинамической системы;
- • экзотермические и эндотермические химические реакции;
- • нулевой, первый, второй и третий законы термодинамики, закон Гесса, тепловой эффект химической реакции;
уметь
- • определять тип термодинамической системы, но заданным условиям;
- • различать свойства и функции состояния системы;
- • рассчитывать изменения функций состояния термодинамической системы и тепловой эффект химических реакций при постоянных давлении и объеме;
владеть
- • навыками определения типа термодинамической системы по заданным условиям;
- • методами проведения термодинамических расчетов.
Основные понятия термодинамики
Изначально термодинамика возникла как наука о «движении тепла» в начале XIX в. и была теоретической базой создания тепловых машин (в основном паровых котлов). Сейчас термодинамика описывает энергетические состояния и их изменения в системах, состоящих из огромного числа любых элементов, находящихся в состоянии внутреннего равновесия.
Химическая термодинамика — перенос законов термодинамики на случай, когда в системе протекают химические процессы.
Важны термодинамическое описание и основные решения двух задач:
- • каковы энергетические характеристики термодинамических систем (выделение или затраты энергии);
- • каковы возможности предсказания направлений протекания самопроизвольных химических процессов в них.
Энергия. Понятие энергии — одно из основных физических понятий и потому не имеет исчерпывающего определения. Для наших целей примем следующее определение.
Энергия — характеристика движения и взаимодействия тел, связанная с их способностью совершать изменения в состоянии системы.
Видов энергии очень много — механическая, тепловая, электромагнитная, ядерная и т. д. В соответствии с законом эквивалентности энергии каждая из них не исчезает бесследно, а может только видоизменяться, превращаясь в другие виды.
Термодинамическая система — виртуальная или реальная ограниченная область пространства, занятая элементами системы. Элементами систем в химической термодинамике являются атомы, молекулы, ионы. Элементы могут объединяться в подсистемы, например входить в состав жидкостей, кристаллов или газов. Граница системы может быть как физической (стенки сосуда), так и мысленной. Все, что вне системы, — окружающая среда.
По взаимоотношениям с окружающей средой термодинамические системы бывают трех видов (могут находиться в трех состояниях).
- 1. Изолированные — нет обмена ни веществом, ни энергией с окружающей средой. Пример — герметичный сосуд с газом с теплоизолирующей оболочкой (термос).
- 2. Замкнутые — нет обмена веществом с окружающей средой. Пример — герметически закрытый сосуд, способный отдавать и принимать теплоту (кастрюля-скороварка).
- 3. Открытые — есть и энерго-, и массообмен с окружающей средой. Пример — костер или человек.
Химическая термодинамика изучает только изолированные и замкнутые системы. И изолированность, и замкнутость — идеализированные предельные характеристики. Ни абсолютная изоляция, ни совершенная замкнутость недостижимы. Уровни изоляции и замкнутости, при которых можно считать применимыми законы термодинамики, определяются конкретным типом решаемых задач. Для описания состояния практически значимых объектов в течение достаточно длительных отрезков времени достичь приемлемых уровней изоляции обычно не представляет большого труда, что и предопределяет успех термодинамических предсказаний. Но для решения фундаментальных проблем описания очень больших систем космологического масштаба и для самой общей из достоверно известных нам систем — нашей Вселенной — вопрос о замкнутости и изолированности не имеет однозначного ответа.
Кроме того, по поведению различают равновесные и стационарные состояния систем. Равновесные системы самопроизвольно не изменяют своих состояний. Стационарные системы могут самопроизвольно изменить свою структуру или состояние. Например, металлическое олово может самопроизвольно при низкой температуре превратиться в серый порошок. Состояния системы характеризуются параметрами состояния и функциями состояния.
Параметры состояния системы — это макроскопические свойства, однозначно характеризующие однородные части системы. Термодинамический подход требует, чтобы они были измеримы экспериментально с помощью макроскопических приборов.
В химической термодинамике используются следующие основные параметры: температура Т, давление Р, объем V, масса М (количество молей вещества р). Кроме того, в качестве основных параметров могут быть использованы и такие параметры, как концентрация С, плотность р и химический состав. Основные параметры системы далеко не исчерпывают всех ее термодинамических характеристик. Термодинамическую природу имеют такие свойства, как вязкость, теплопроводность, теплоемкость, коэффициенты теплового расширения и др.
Во всякой термодинамической системе параметры связаны друг с другом уравнениями состояния. Эти уравнения для разных условий и разных систем могут быть различными. Уравнения состояния получают либо опытным путем, либо используя какие-то математические модели, описывающие взаимодействия между элементами системы. Например, для идеальных газов уравнением состояния является уравнение Клапейрона — Менделеева.
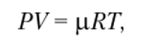
где И — универсальная газовая постоянная, равная 8,314 ДжДмоль* К).
Уравнение состояния позволяет вычислить любой параметр системы, если известны остальные входящие в него параметры. Например, из уравнения Клапейрона — Менделеева можно получить следующие соотношения:
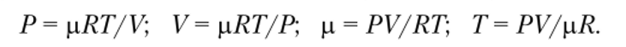
В соответствии с условиями решаемой задачи (вида термодинамической системы и характера протекающих в ней процессов) любое из них может быть принято как расчетное. Параметры, входящие в правую часть выбранного уравнения, считаются независимыми параметрами и могут быть заданы произвольно.
Параметры делятся на интенсивные и экстенсивные.
Интенсивные параметры не зависят от количества вещества в системе (давление, температура, напряженность электрического поля и др.).
Экстенсивные параметры зависят от количества вещества (объем, масса, заряд и др.).
Функции состояния термодинамической системы. При выбранном наборе независимых параметров состояние системы может быть охарактеризовано определенными функциями этих параметров, которые называются функциями состояния термодинамической системы. Эти функции однозначно характеризуют состояние. Однозначность проявляется в том, что функции состояния не зависят от того, как система попала в данное состояние, а определяются только текущими значениями параметров.
Рассмотрим в качестве примера термодинамическую функцию состояния системы, называемую внутренней энергией. В химической термодинамике внутренняя энергия системы II — это часть полной энергии термодинамической системы, которая не зависит от выбора системы отсчета и которая в рамках рассматриваемой задачи может изменяться.
В соответствии с этим определением она не включает кинетическую и потенциальную энергии системы как целого (они зависят от системы отсчета) и не включает ядерную энергию атомов и молекул, поскольку в химических процессах она не изменяется. Иными словами, внутренняя энергия системы — это сумма энергий атомно-молекулярных взаимодействий и теплового движения частиц системы.
Внутренняя энергия зависит от термодинамических параметров — температуры, давления, объема и химического состава, и однозначно характеризует состояние рассматриваемой системы.
Внутренняя энергия системы V — суммарная энергия всех составных частей системы и их взаимодействий. Это сумма энергий атомных и молекулярных взаимодействий и теплового движения частиц внутри системы.
Она нс включает кинетической и потенциальной энергии системы как целого.
Термодинамические процессы. Особое свойство в термодинамике имеет время. Оно лишено такого своего качества, как длительность, и проявляется только как фиксация качественных изменений. В термодинамике рассматривается не ход процесса, а только его результат. Событие в термодинамике — это изменение параметров в ходе термодинамического процесса.
Разумеется, на практике временной фактор играет существенную роль. И временные интервалы термодинамических процессов лежат в широчайших пределах. Так, одним из самых быстрых тепловых процессов, реализованных технически, стал лазерный нагрев нанолитра воды за одну триллионную долю секунды до температуры 600° (источник: Angewandte Chemie International Edition. 2013. 23 oct. Vol. 52. Iss. 51. URL: http://onlinelibrary. wiley. eom/doi/10.1002/anie.201 305 991/pdf). Это пример экспериментальной работы с предельно малой термодинамической системой.
А самым медленным является процесс остывания нашей Вселенной — самой большой из известных термодинамических систем — от Большого взрыва с температуройТО32 К до нынешних 2,7 Кза 13,7 млрд лет. С точки же зрения термодинамики оба эти процесса — рядовые события в адиабатических системах, подчиняющиеся тем же законам и описываемые теми же формулами, что и процессы в термосах и холодильниках.
Термодинамические процессы классифицируются, но разным критериям.
По конечному результату — разомкнутые и циклические. Разомкнутые процессы — это процессы, в результате которых параметры конечного состояния отличаются от начальных. Циклические процессы — это процессы, в результате которых параметры конечного состояния приобретают исходные значения.
По характеру взаимодействия с окружающей средой: обратимые и необратимые. Обратимые процессы не оставляют изменений в окружающей среде. Необратимые процессы после их завершения сопровождаются изменениями в окружающей среде.
По местонахождению причины-, самопроизвольные и вынужденные. Самопроизвольные процессы побуждаются внутренними причинами самой системы. Вынужденные процессы побуждаются причинами, лежащими в окружающей среде.
По способу проведения процесса: изотермический, изобарический (изобарный), изохорический (изохорный), адиабатический (адиабатный) и подтропический (политропный).
Изотермический процесс — процесс, протекающий при постоянной температуре.
Изобарический {изобарный) процесс — процесс, протекающий при постоянном давлении.
Изохорический (изохорный) процесс — процесс, протекающий при постоянном объеме.
Адиабатический (адиабатный) процесс — процесс, протекающий без обмена энергией с окружающей средой.
Политропический (политропный) процесс — процесс, протекающий без изменения теплоемкости системы.
Универсальные условия существования термодинамических систем.
Термодинамические системы на практике существуют в широком диапазоне параметров — давлений, температур и составов. Для того чтобы иметь возможность сравнивать свойства различных систем, необходимо привести их к одинаковым условиям существования.
В термодинамике существуют два набора условий для сравнения свойств систем — нормальные условия и стандартные условия.
Нормальные условия (н.у.) включают в себя обязательные значения температуры Т= 273,15 К (0°С) и давления Р = 101 325 Па (760 мм рт. ст., 1 атм). При этом объем одного моля идеального газа принимается равным 22,414 л.
Стандартные условия включают в себя обязательное значение давления Р = 1 бар (10' Па, или 750,06 мм рт. ст.) и обязательные требования к состоянию вещества. Оно должно быть чистым и в стабильном состоянии (скажем, для олова — это состояние p-Sn, белое олово, а не a-Sn, серое олово). Для веществ, находящихся в растворах, стандартным является состояние при концентрации 1 моль/л. В определение стандартного состояния не входит температура, хотя обычно принимают в качестве стандартной температуру, равную 25 °C (298,16 К).
Стандартные условия обозначаются верхним индексом «0» у рассматриваемой величины, например U0 — значение внутренней энергии системы, находящейся при стандартных условиях.
Само понятие «стандартные условия» предполагает введение произвольных значений параметров, которые должны быть удобными для применения. Поскольку области параметров, с которыми приходится иметь дело в современных науке и технике, весьма широки, в приведенном описании стандартных условий учтены только наиболее часто используемые характеристики. С детальным описанием выбора стандартного состояния в химии можно ознакомиться по рекомендациям комиссии по термодинамике ИЮПАК (Международного союза по чистой и прикладной химии) (источник: ШРАС. Compendium of chemical terminology. 2nd ed. (the Gold Book). Compiled by A D. McNaught and A Wilkinson. Oxford: Blackwell Scientific Publications, 1997. URL: http://goldbook.iupac.org/S05925.html).