Ковалентная связь и метод валентных связей (ВС)

У атомов элементов третьего и последующих периодов в образовании ковалентных связей могут участвовать не только 5- и р-орбитали внешнего слоя, но также и d-орбитали предшествующего слоя. Максимальная ковалентность элементов третьего периода равна 6, так как в образовании химической связи могут участвовать одна S-, три р- и только две d-орбитали по стерическим или пространственным причинам… Читать ещё >
Ковалентная связь и метод валентных связей (ВС) (реферат, курсовая, диплом, контрольная)
В основе метода ВС лежит принцип обобществления электронных пар. Суть его заключается в том, что связь между атомами осуществляется обобществлением одной или нескольких пар электронов, при этом электронная плотность между ядрами атомов увеличивается, а общая энергия молекулы как системы уменьшается. Такая связь получила название ковалентной. Она локализована между двумя атомами и поэтому является двухцентровой.
Метод ВС впервые был применен в 1927 г. немецкими учеными В. Гейтлером и Ф. Лондоном для квантово-механического расчета молекулы водорода (Н2). Они получили уравнения, позволяющие найти зависимость потенциальной энергии системы, состоящей из двух атомов водорода, от расстояния между ядрами этих атомов (рис. 3.1).
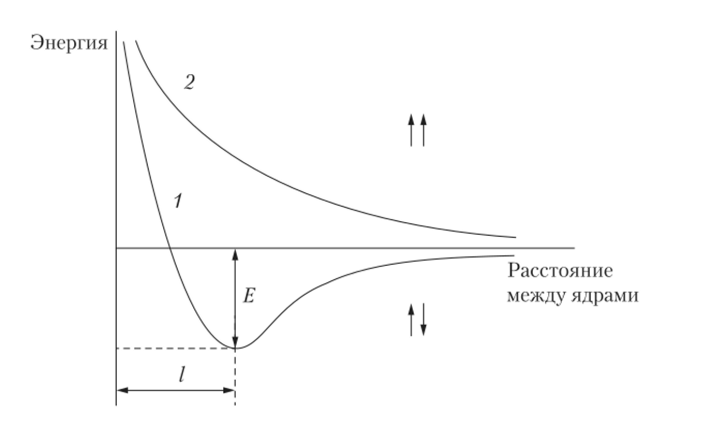
Рис. 3.1. Зависимость энергии системы из двух атомов водорода от расстояния между их ядрами:
1 — при антипараллельных спинах; 2 — при совпадающем направлении спинов Оказалось, что при антипараллельных спинах сближение атомов до некоторого расстояния (/) сопровождается уменьшением энергии системы (кривая 1), что и служит доказательством образования устойчивой молекулы Н2. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы (кривая 2). В этом случае для сближения атомов требуется затрата энергии. Такой процесс является энергетически невыгодным, и химическая связь между атомами не возникает.
Позднее метод ВС получил дальнейшее развитие и был распространен на другие молекулы. Он базируется на следующих основных положениях:
- • ковалентная химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар (обобществление двух электронов);
- • в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллелъными спинами;
- • прочность химической связи усиливается с увеличением степени перекрывания взаимодействующих электронных облаков и поэтому ковалентная связь образуется в том направлении, при котором это перекрывание максимально.
Различают обменный и донорно-акцепторный механизмы образования ковалентной связи.
1. Обменный механизм: каждый атом дает по одному неспаренному электрону с антипараллельными спинами в общую электронную пару.
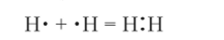
2. Донорно-акцепторный механизм: один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
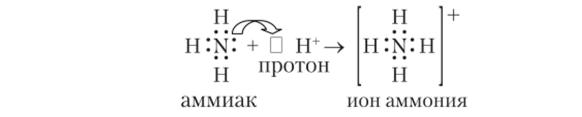
В данном примере донором является атом азота в аммиаке (NH3), а акцептором — ион водорода (Н ').
Таким образом, ковалентная связь может образовываться за счет спаривания неспаренных электронов различных атомов, а также по донорно-акцепторному механизму.
Два атома могут обобществлять несколько пар электронов. В этом случае говорят о кратных (двойных, тройных) ковалентных связях.
Согласно обменному механизму метода ВС каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Поэтому количественной мерой валентности атома в обменном механизме метода ВС считают число его неспаренных электронов. В связи с вышеуказанным валентности элементов второго периода Периодической системы элементов объясняются следующим образом (рис. 3.2). Так как электроны внутреннего заполненного первого энергетического уровня (Is2) у этих элементов не принимают участия в образовании химической связи, то на рис. 3.2 представлены только энергетические конфигурации второго (валентного) электронного подуровня.
По числу неспаренных электронов у рассматриваемых элементов можно сделать вывод о том, что литий (Li) одновалентен. Валентность бериллия (Вс) равна нулю. Однако.
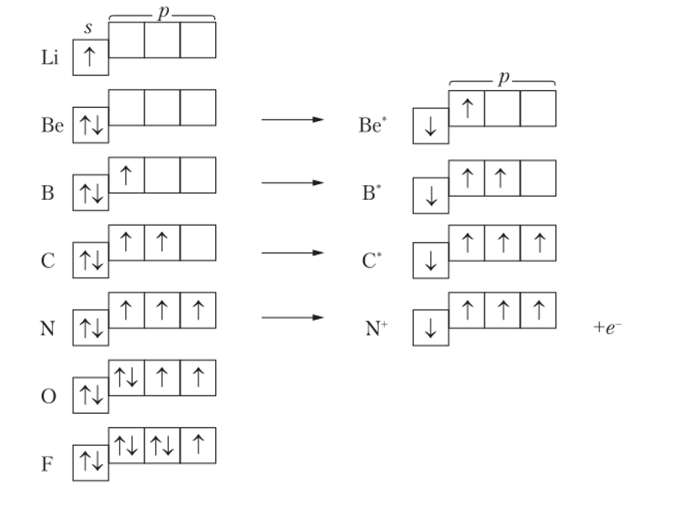
Рис. 3.2. Структуры второго внешнего подуровня элементов второго периода Периодической системы элементов
при возбуждении атома Be происходит распаривание его электронной пары, находящейся на уровне 2л с переходом одного электрона на незаполненный более высокий энергетический подуровень 2 р. Таким образом, Be в возбужденном состоянии становится способным проявить валентность равную 2 (но числу неспаренных электронов). Затраты энергии на распаривание электронной пары и перевод одного электрона на более высокий энергетический подуровень в данном случае достигают значения 324 кДж/моль.
Аналогичным образом изменяются валентности двух последующих элементов: бора (В) и углерода ©. Атом бора в нормальном состоянии одновалентен, а в возбужденном (минимальные энергетические затраты 531 кДж/моль) — трехвалентен. Атом углерода в нормальном состоянии двухвалентен, а в возбужденном (минимальные энергетические затраты 402 кДж/моль) — четырехвалентен.
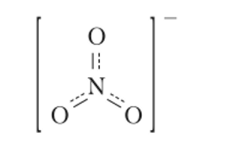
Атом азота (N) не может иметь пять неспаренных электронов, так как у него нет незаполненных орбиталей и электрону некуда перемещаться при распаривании электронной пары с подуровня 2s. При взаимодействии с другими атомами атом азота отдает им один электрон и превращается в четырехвалентный катион N+ (N —> N+ + ё, минимальные энергетические затраты 1405 кДж/моль). Атом элемента, реагирующего с азотом, присоединяет этот электрон и, заряжаясь отрицательно, притягивается к катиону N+. На примере азотной кислоты можно представить четыре связи атома азота, образуемые им с атомами кислорода, следующим образом: h-O-N^ • Однако два атома кислорода в химической связи равноценны, и поэтому между ними четвертая связь атома азота делится поровну, а перешедший от него электрон принадлежит им в равной степени. Таким образом, структурная формула азотной кислоты может быть представлена следующим образом:
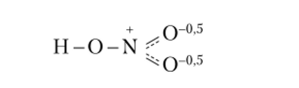
Следовательно, в молекуле азотной кислоты связь между атомом азота и двумя атомами кислорода, не связанными с атомом водорода, в среднем полуторная. Таким образом, валентность атома азота в HN03 равна четырем, а данная процедура определения валентности в методе ВС получила наименование способ валентных схем. Согласно этому способу при рассмотрении связей в молекуле N20 применяют наложение следующих двух валентных схем:
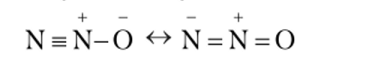 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">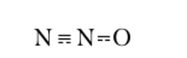
что приводит к указанному ниже распределению связей, называемому мезомерным эффектом (от ре?, с6а, мезос — греч. средний, срединный):
Отсюда в молекуле N20 связь между атомами азота соответствует кратности 2,5, а между атомами азота и кислорода — полуторная.
Валентные схемы для нитратного аниона (NO") имеют следующий вид:
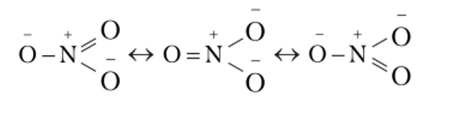
Их изучение показывает, что все связи атома азота с атомами кислорода одинаковы, поэтому анион геометрически имеет форму правильного треугольника с валентным углом 120°, с кратностью связей 4/3 или 1 Уз.
Атомы кислорода, фтора и следующего за ними элемента пеона из-за отсутствия свободных орбиталей, на которые можно перевести распаренные электроны, имеют постоянные валентности, равные соответственно 2, 1 и 0.
Принципиальное отличие атомов фосфора, мышьяка, сурьмы и висмута (Р, As, Sb, Bi) от атома азота, находящегося с ними в одной группе 15 Периодической системы элементов, заключается в том, что внешний электронный подуровень у этих элементов имеет вакантные ^/-орбитали, на которые могут быть переведены электроны при распаривании электронных пар. Это позволяет увеличить число Таким образом, указанные элементы могут проявлять валентность 3 и 5. Именно поэтому существует соединение PF5, но не существует молекулы NF-, а только NFr
Аналогичным образом происходит процесс увеличения валентности у элементов группы 16 Периодической системы элементов: серы, селена, теллура и полония (S, Se, Те, Ро), в которую входит, однако, и атом кислорода:
В отличие от атома кислорода, у которого валентность в основном постоянна и равна двум, указанные выше элементы группы 16 Периодической системы элементов (S, Se, Те, Ро) могут иметь валентности 2, 4 и 6. Поэтому существуют, например, соединения S?i и SFG, но не существуют OF, И OF6.
Атомы хлора, брома, йода и астатина (Cl, Br, I, At) в отличие от одновалентного фтора, находящегося с ними в одной группе 17 Периодической системы элементов, могут иметь валентность 1, 3, 5 и 7:
неспаренных электронов и валентность при возбуждении данных элементов до пяти:


Поэтому, например, у йода со фтором имеются межгалогенные соединения IF, IF3, IF-, IF?, а не наоборот.
Наконец, атомы благородных газов, теоретически начиная с аргона, согласно методу ВС, могут иметь валентности 2, 4, 6 и 8. В настоящее время получено сравнительно большое число соединений ксенона указанных валентностей и около десятка соединений криптона, проявляющего валентности 2, 4 и 6.
У атомов ^/-элементов валентными являются внешний-подуровень, на котором находятся один или два электрона, и внутренний (п — 1) б/-подуровень. Таким образом, валентность-элементов в соединениях может изменяться от 1 или 2 вплоть до величины, равной суммарному числу их внешних (валентных) электронов.
Однако ковалентная связь может образовываться не только по обменному, но и по донорно-акцепторному механизму. В этом случае связь образуется за счет занятия готовой электронной парой одного элемента (донора) вакантной орбитали другого элемента (акцептора). В одном соединении химические связи могут быть образованы как по обменному, так и по донорно-акцепторному механизмам. Например, в молекуле оксида углерода (П) СО имеется прочная тройная связь, хотя атомы углерода и кислорода в невозбужденном состоянии имеют по два неспаренных электрона, перекрыванием которых образуется двойная химическая связь. Третья связь, согласно методу ВС, образуется по донорно-акцепторному механизму, при котором неподеленная пара электронов кислорода занимает вакантную орбиталь атома углерода.

Таким образом, суммарная валентность элемента равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных по донорно-акцепторному механизму.
Свою насыщаемость связями атом может увеличить за счет дативной связи (D-связи), которая представляет собой обратную донорно-акцепторную связь, схематично изображенную на рис. 3.3.

Рис. 33. Принципиальная схема образования дативных.
связей На представленной схеме показано, что дативная связь может образоваться по крайней мере двумя путями — перенесением пары d-электронов акцептора на вакантные р- или J-орбитали атома донора. Первый тип дативной связи (d-p взаимодействие) имеет место тогда, когда донором является атом элемента второго периода (N из NO;, С из СО или из CN~ и т. п.). Второй тип связи (d-d взаимодействие) может возникнуть, если донором является атом элемента третьего или последующих периодов (Р, S и т. д.), которые имеют вакантные ^/-орбитали.
При использовании всех своих атомных орбиталей (АО) для образования химических связей, атом химически насыщается и становится не способным к образованию новых химических связей. Этим объясняется одно из основных свойств ковалентной связи — ее насыщаемость.
Так, атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали (одну s- и три р-орбитали), на которых могут разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна 4.
У атомов элементов третьего и последующих периодов в образовании ковалентных связей могут участвовать не только 5- и р-орбитали внешнего слоя, но также и d-орбитали предшествующего слоя. Максимальная ковалентность элементов третьего периода равна 6, так как в образовании химической связи могут участвовать одна S-, три р- и только две d-орбитали по стерическим или пространственным причинам. У элементов четвертого периода максимальная ковалентность достигает 9, так как в образовании ковалентной связи могут участвовать одна 5-, три р- и все пять d-орбиталей.
Другое важное свойство ковалентной связи — ее направленность в пространстве.
Так как атомные орбитали (АО) ориентированы в пространстве, то при образовании молекулы перекрывание электронных облаков составляющих ее атомов происходит по определенным направлениям, что и обусловливает направленность ковалентной связи.
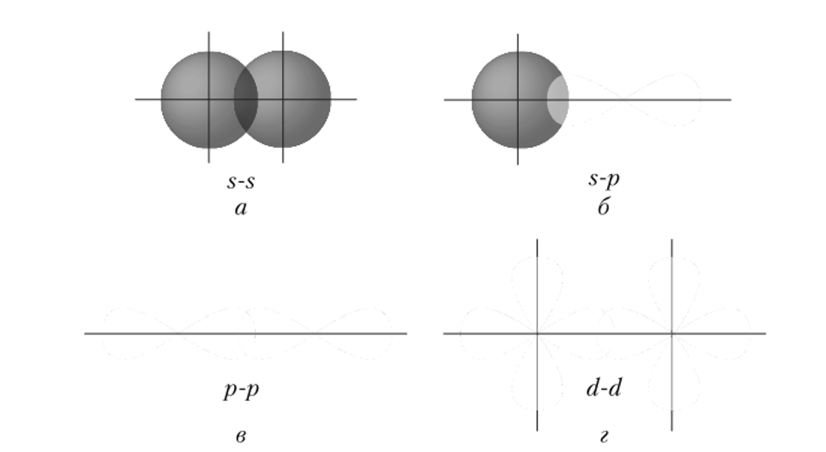
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется о-связыо (сигма-связыо). Она может возникать при перекрывании двух s- (рис. 3.4, а), s- и р- (рис. 3.4,.
б), двух р- (рис. 3.4, в), двух d- (рис. 3.4, г), d- и s-, dи р-, а также /-орбиталей друг с другом и другими орбиталями.
Связь, образованная перекрыванием АО по обе стороны от линии, соединяющей ядра атомов (боковое пере.
рос. ЗА. Перекрывание атомных орбиталей при образовании а-связей крывание), называется к-связью (пи-связью). Она может образовываться при перекрывании двух р- (рис. 3.5, а), р- и с1- (рис. 3.5, б), двух d- (рис. 3.5, в), двух/-, а также/- и р-, /- и d-орбиталей.
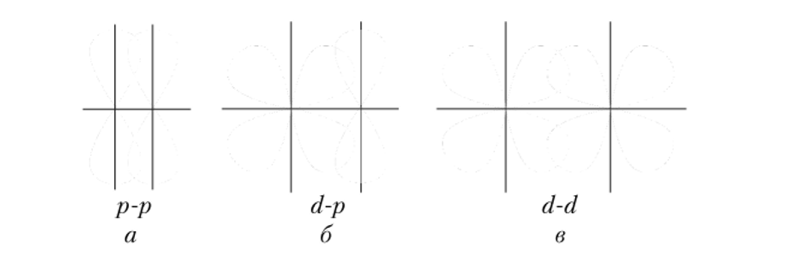
Рис. 3.5. Перекрывание атомных орбиталей при образовании.
я-связей Связь, образованная перекрыванием ^/-орбиталей всеми четырьмя лепестками, называется 5-связью (дельта-связыо).
Исходя из вышеизложенного, s-элементы могут образовывать только а-связи, р-элементы — аи л-связи, d-элементы — а-, ли 5-связи, f-элемепты — а-, л-, 5- и еще более сложные химические связи.
Наибольшей прочностью обладают a-связи, наименьшей — 8-связи.
Кроме простых одинарных связей существуют кратные (двойные и тройные) связи, образующиеся при наложении а-, к- и 8-связей. Они изображаются соответственно двумя или тремя черточками. При наложении одной л-связи на a-связь образуется двойная связь (например, между атомами углерода в молекуле этена (этилена) Н2С=СН2 и кислорода. В молекуле кислорода 0=0 имеется одна аи одна л-связь), а при наложении двух л-связей на a-связь возникает тройная связь (например, между атомами углерода в молекуле этина (ацетилена) НС=СН и азота, в молекуле которого N=N имеются одна аи две л-связи).
С увеличением кратности общая прочность связи возрастает, при этом длина а-связи уменьшается, т. е. уменьшается межядерное расстояние между взаимодействующими атомами. Так, длина одинарной ковалентной связи С~С равна 0,154 нм, двойной связи — 0,134 нм, а длина тройной связи между атомами углерода — 0,122 нм.
Направленность ковалентных связей в пространстве придает многоатомным частицам (молекулам, ионам, радикалам и т. п.) определенную пространственную форму или конфигурацию.