Строение электронных оболочек атомов различных химических элементов

Многочисленные экспериментальные факты свидетельствуют, что поведение электронов в атоме не может быть правильно описано в рамках классической механики, базирующейся на уравнении И. Ньютона. Начиная с 1920 г. появился новый раздел физики — квантовая механика, которая позволила объяснить природу многих явлений, включая происхождение атомных и молекулярных линейчатых спектров, стехиометрию… Читать ещё >
Строение электронных оболочек атомов различных химических элементов (реферат, курсовая, диплом, контрольная)
Химические свойства любого химического элемента в Периодической системе элементов определяются строением его атома. В химических реакциях ядра атомов не претерпевают трансформаций, изменяется лишь строение их наружных (внешних) электронных оболочек.
Многочисленные экспериментальные факты свидетельствуют, что поведение электронов в атоме не может быть правильно описано в рамках классической механики, базирующейся на уравнении И. Ньютона. Начиная с 1920 г. появился новый раздел физики — квантовая механика, которая позволила объяснить природу многих явлений, включая происхождение атомных и молекулярных линейчатых спектров, стехиометрию и пространственное строение молекул, механизмы химических реакций и др. Как и классическая механика, квантовая теория базируется на фундаментальном уравнении, носящем имя открывшего его ученого, — уравнении Шредингера (1926 г.), которое представляет собой дифференциальное уравнение в частных производных для функции состояния, или волновой функции |/ (л;, у, г) (пси-функции). Это уравнение связывает волновую функцию с потенциальной (1Т)у полной (Е) и кинетической энергиями электрона, что выражается в виде суммы частных производных. В простейшем случае оно может быть записано в следующем виде:

где h — постоянная Планка (6,625 • 10~27 эрг е или 1,0546 • 10~34 Джс); m — масса электрона (9,1 • 10~28 г); U и Е — потенциальная и полная энергия электрона; х, у, z — декартовы координаты электрона в пространстве; / — волновая функция.
Определить точно энергию и положение электрона одновременно невозможно, поэтому в квантово-механической модели атома используют вероятностный подход. Вероятность нахождения электрона в определенной области пространства описывается волновой функцией |/, которая характеризует амплитуду стоячей волны как функцию координат электрона (х, у, г). Орбиталью называется область пространства, в котором наиболее вероятно нахождение электрона, движущегося относительно ядра. Вероятность обнаружения электрона в заданной области пространства (dP) с величиной 95% выражается произведением dP = |/2 (х, у у z) • dV. Так как электрон несет отрицательный заряд, го его орбиталь представляет собой определенное распределение этого заряда в пространстве, получившее название электронного облакау плотность которого пропорциональна квадрату волновой функции, называемому плотностью вероятности.
Волновые функции ф зависят от декартовых координат электрона (х, у, z). Однако, учитывая сферическую симметрию водородоподобных систем, в целях удобства волновые функции электронов выражают через сферические координаты (г, 0, ф), которые представлены на рис. 2.1.

В этом случае атомные волновые функции могут определяться в виде произведения двух функций:

где R (г) — радиальная функция, отвечающая за характер изменения плотности электронного облака по мере удаления от атомного ядра; Y (б, ф) = 0 (б) • Ф (ф) — сферическая функция, описывающая вероятность нахождения электрона в пространстве в зависимости от углов 0 и ф, т. е. форму и ориентацию электронного облака.
Рис. 2.1. Полярная система координат.
Так как в сферической системе координат элементарный объем шарового слоя толщиной dr на расстоянии г от ядра атома равен dV = Am2dr, то функция радиального распределения вероятности нахождения электрона в данной области пространства атома выражается уравнением dP = Am2i2dr. Так как величина ф2 пропорциональна Л2, то dP = An^lRfdr.
Пунктирная стрелка показывает проекцию радиуса-вектора на плоскости ху
Наличие трех степеней свободы движения электрона приводит к тому, что в решении уравнения Шредингера проявляются три величины, которые могут принимать только целочисленные значения — три квантовых числа (п, I и т,). Эти величины входят в выражения как радиальной, так и сферической составляющих волновой функции. В самом общем виде результат решения уравнения Шредингера для водородоиодобных систем можно выразить записью:
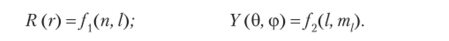
Аналитический вид формул для расчета радиальной волновой функции, а следовательно, и функции радиального распределения вероятности нахождения электрона в данной области пространства от безразмерного радиуса р = '2Zr/na0, где а0 — боровский радиус (радиус первой от ядра стационарной орбиты электрона), равный 0,529 • 10~10 м, приведены в табл. 2.1.
Таблица 2.1
Уравнения для вычисления радиальной волновой функции.
п | К, | |
R o=2'(Z / а0 )3/2 • ехр (-р / 2) | ||
R2o~ (2 Р)? ехр (р/2) | ||
*21 р-ехр (р/2) | ||
(7 / (I 3/2. *30 — д_Л -(6 6р + р2) ехр (р/2) | ||
(Z / а *31= ^ (4 р)• Р• ехр (р/2) | ||
Графики функций Rnl, R2t и Anr2Rftl приведены на рис. 2.2.
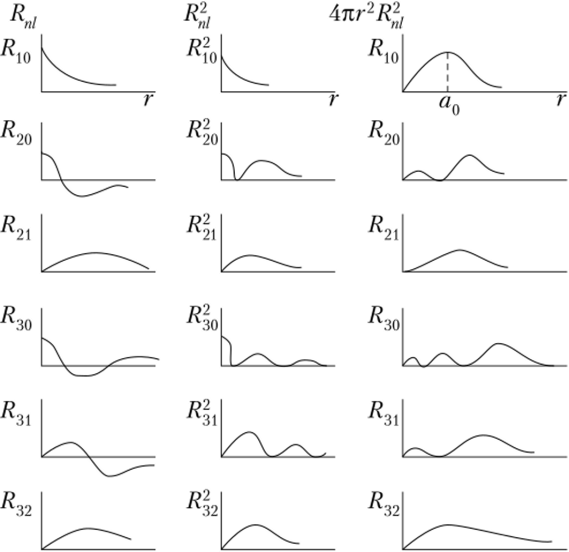
Рис. 2.2. Графики функций Rnl, и 4nr2R^f связанных с решением радиального уравнения Шредингера.