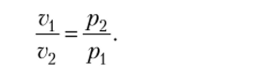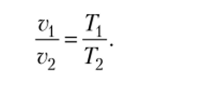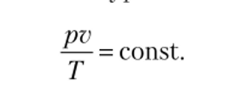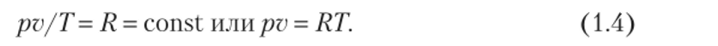Идеальным газом называется газ, в котором пренебрегают потенциальной энергией силового взаимодействия между молекулами, а также объемом самих молекул.
Зависимость между параметрами идеального газа описывается законами Бойля — Мариотта, Гей — Люссака.
Закон Бойля — Мариотта. При постоянной температуре объем газа изменяется обратно пропорционально его давлению:
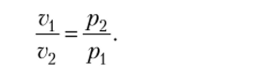
Закон Гей — Люссака. При постоянном давлении удельные объемы газа изменяются прямо пропорционально абсолютным температурам:
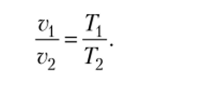
Уравнение состояния идеального газа. Совместное решение законов Бойля — Мариотта и Гей — Люссака позволяет получить уравнение состояния, или характеристическое уравнение идеального газа,.
Уравнение состояния идеального газа может быть получено исходя из молекулярно-кинетической теории газа в виде.
Постоянную R в уравнениях называют газовой постоянной
Уравнение состояния реального газа. Для реального газа может быть использовано уравнение Ван-дер-Ваальса:
В уравнении состояния реального газа величина a /v[1] учитывает влияние сил притяжения между молекулами на внутреннее давление газа, а величина Ь является собственным объемом молекул.
- [1] Поскольку для каждого газа существует свое значение постоянной R, ее иногда называют индивидуальной газовой постоянной.