Температуры замерзания и кипения растворов

Растворы нелетучих веществ всегда начинают замерзать при более низкой температуре, чем растворитель (индивидуальная жидкость), а кипеть — при более высокой температуре. Процесс замерзания раствора представляет собой постепенное вымораживание растворителя, причем температура замерзания в этом процессе продолжает понижаться, так как оставшийся раствор становится более концентрированным. Поэтому… Читать ещё >
Температуры замерзания и кипения растворов (реферат, курсовая, диплом, контрольная)
Индивидуальные вещества характеризуются постоянными температурами плавления (замерзания) и кипения. Они входят в число физических констант, характеризующих вещество, и обязательно приводятся в справочниках. Если обнаруживается отклонение температуры плавления или кипения от табличного значения, то это признак присутствия растворимых примесей. Получается, что раствор имеет температурные константы, отличающиеся от констант индивидуального вещества.
Как пример, вода при нормальном атмосферном давлении замерзает при О °С и кипит при 100 °C; бензол С6Н6 замерзает при 5,5 °С, а кипит при 80,1 °С. Эти температуры замерзающей или кипящей жидкости сохраняются неизменными до тех пор, пока вся жидкость не замерзнет или не превратится в пар.
Иначе обстоит дело с разбавленными растворами нелетучих твердых веществ. Под замерзанием раствора подразумевается выделение кристаллов растворителя, а под кипением — образование пара растворителя в процессе кипения.
Растворы нелетучих веществ всегда начинают замерзать при более низкой температуре, чем растворитель (индивидуальная жидкость), а кипеть — при более высокой температуре. Процесс замерзания раствора представляет собой постепенное вымораживание растворителя, причем температура замерзания в этом процессе продолжает понижаться, так как оставшийся раствор становится более концентрированным. Поэтому характеризовать раствор может только температура начала замерзания. Все то же самое относится и к температуре кипения раствора.
Причиной понижения температуры замерзания и повышения температуры кипения растворов можно считать понижение давления пара растворителя над раствором. Для уяснения этого рассмотрим диаграмму состояния воды, на которой добавим кривую зависимости давления пара воды над раствором от температуры (рис. 12.11). Она проходит ниже, чем соответствующая зависимость для чистой воды. Вода и лед находятся в равновесии при равных давлениях паров воды над обеими фазами. При этом условии равны и их химические потенциалы. Взяв вместо воды раствор, мы понизим давление пара. Точка пересечения кривой давления пара для льда и для раствора сместится в сторону более низкой температуры. Это будет температура, при которой лед и раствор находятся в равновесии, или температура замерзания раствора.

Рис. 12.11. Кривые давления пара воды над льдом, жидкостью
и раствором
Раствор начнет кипеть, когда давление пара над ним достигнет 101,3 кПа. Из-за понижения давления пара это состояние наступает при более высокой температуре, чем у чистой воды. Таким образом, температура кипения раствора повышена относительно температуры кипения чистого растворителя.
Количественные зависимости для температур замерзания и кипения растворов были установлены Раулем. Понижение температуры замерзания ДГзам и повышение температуры кипения АТКШ не зависят от природы растворенного вещества, но зависят от концентрации раствора и природы растворителя. Наиболее удобным способом выражения концентрации для этих зависимостей оказалась моляльная концентрация ст (с. 242).
Понижение температуры замерзания разбавленного раствора нелетучего вещества пропорционально моляльной концентрации раствора: 
В уравнении (12.8) АТЗШ= Гзамр.ль — Гзамр.ра. Постоянная Кк, называемая криометрической постоянной растворителя, имеет разные значения для разных жидкостей. Она имеет размерность (К-кг)/моль и численно равна понижению температуры замерзания раствора с концентрацией 1 моль/кг. В табл. 12.2 приведены криометрические постоянные ряда жидкостей.
Зависимость ДГКИП от концентрации растворенного вещества имеет совершенно такой же характер, как зависимость для АГзам.
Повышение температуры кипения разбавленного раствора нелетучего вещества пропорционально моляльной концентрации раствора: 
Постоянная Ке называется эбулиометрической постоянной растворителя. Численно эта константа равна повышению температуры кипения раствора с концентрацией 1 моль/кг в данном растворителе. Константы Ке также приведены в табл. 12.2.
Таблица 12.2
Константы некоторых жидкостей.
Вещество. | 7зам, °С. | Криомегрическая постоянная, Ккг/моль. | 7кин, °С. | Эбулиометрическая постоянная, Ккг/моль. |
Вода. | 1,86. | 0,513. | ||
Этанол. | — 114,14. | ; | 78,29. | 1,23. |
Диоксан. | — 45. | 4,63. | 106,1. | 3,01. |
Диэтиловый эфир | — 116,2. | 1,79. | 34,5. | 2,20. |
Уксусная кислота. | 16,64. | 3,63. | 117,9. | 3,22. |
Циклогексан. | 6,59. | 20,8. | 80,73. | 2,92. |
Бензол. | 5,495. | 5,07. | 80,09. | 2,64. |
Нитробензол. | 5,7. | 6,87. | 210,9. | 5,2. |
Хлороформ. | — 63,41. | ; | 61,717. | 3,80. |
Камфора. | 178,8. | 37,8. | 207,4. | ; |
Измерения температур замерзания и кипения разбавленных растворов являются хорошим методом определения молярных масс веществ в растворах. Соответствующие методы называются криометрией и эбулиометрией. Рассмотрим применение метода криометрии. Для этого представим в развернутом виде выражение для моляльной концентрации:
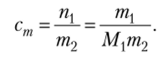
Масса растворенного вещества тх выражается в граммах, а масса растворителя т2 должна быть выражена в килограммах. Взвешивание веществ в химических экспериментах обычно производится в граммах, и поэтому в уравнение следует ввести коэффициент перехода 1000 г/кг:
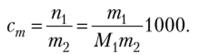
Подставляем выражение для моляльности в уравнение закона Рауля:
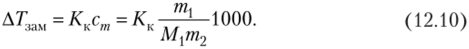
Если для приготовления раствора взяты точно известные массы растворителя и растворенного вещества и определено понижение температуры замерзания раствора, то единственной неизвестной величиной остается молярная масса вещества, которая рассчитывается из полученного уравнения.
Пример 12.14. При растворении 2,76 г глицерина в 200 г воды получился раствор с температурой замерзания -0,279 °С. Рассчитайте молярную массу глицерина.
Решение. Очевидно, что понижение температуры замерзания составило 0,279 °С. По абсолютной шкале температур понижение температуры замерзания выразится тем же числом. Для сокращения единиц измерения в уравнение для расчета подставим Д7', К. Преобразуем уравнение (12.10) для расчета молярной массы глицерина М[ и подставляем численные значения:
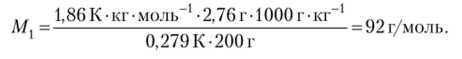
Можно проверить правильность полученного значения суммированием атомных масс для формулы глицерина С3Н803.