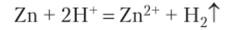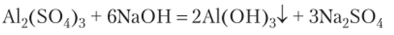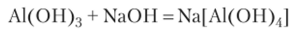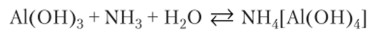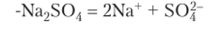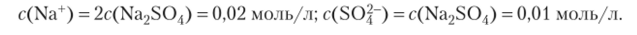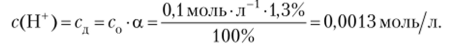Химические реакции в растворах электролитов идут с участием ионов. Скорость таких реакций и состояние химического равновесия зависят от концентраций ионов. Рассмотрим некоторые примеры.
Пример 13.6. Пусть взяты растворы НС1, НВг и СН3СООН одной и той же концентрации с= 1 моль/л. В каждый раствор брошена гранула цинка. В первых двух растворах на цинке начинается быстрое образование пузырьков водорода, которые сплошным потоком поднимаются к поверхности (рис. 13.4). В третьем растворе водород образуется медленно и поднимается отдельными пузырьками. Первые два раствора содержат полностью ионизированные сильные кислоты, и одинаковая скорость реакций означает, что они реагируют не как целое, а в реакциях участвуют только ионы водорода: 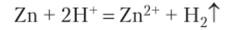
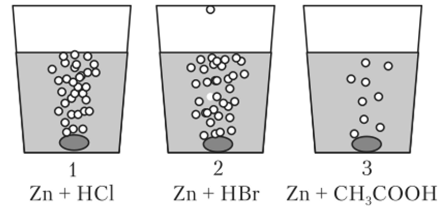
Рис. 134. Растворение цинка в сильных и слабой кислотах (к примеру 13.6).
Анионы С1″ и Вг" на протекание реакции не влияют. В третьем растворе реакция идет медленно, так как слабая уксусная кислота создаст концентрацию ионов водорода приблизительно в 100 раз меньше. Однако по мере их расходования равновесие диссоциации кислоты смещается вправо, и реакция не останавливается.
Пример 13.7. Представим себе получение в пробирке нерастворимого в воде гидроксида алюминия:
Поделив поровну полученную взвесь на две пробирки, добавим в одну избыток раствора гидроксида натрия, а в другую раствор аммиака. В первой пробирке идет реакция, и гидроксид алюминия растворяется:
Во второй пробирке нерастворимое вещество не исчезает. Слабое основание NH3 не дает достаточной концентрации ионов ОН~ для полного растворения осадка:
Итак, сила электролитов проявляется в протекании химических реакций. Она влияет как на скорость, так и на смещение равновесия в том или ином направлении. Во многих случаях различие между электролитами сводится к разной степени диссоциации и разной концентрации ионов. Отсюда возникает задача расчета концентраций ионов.
Обычный способ выражения концентраций ионов — молярная концентрация, моль/л.
Пример 13.8. Рассчитайте концентрации ионов в растворе сульфата натрия с концентрацией c (Na2SO^) = 0,01 моль/л.
Решение. Сульфат натрия — сильный электролит, так как это соль:
Учитывая стехиометрические коэффициенты, определяем концентрации ионов: 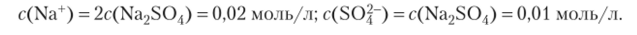
Для расчета концентраций ионов в растворах слабых электролитов необходимо знать степень диссоциации или использовать константы диссоциации (пример 13.4).
Пример 13.9. В растворе уксусной кислоты с концентрацией с = 0,1 моль/л степень диссоциации а= 1,3%. Рассчитайте концентрацию ионов водорода.
Решение. Как показано в примере 13.4, с (Н+) = сд. Находим концентрацию ионов водорода: