Сила кислот и оснований

Каждый вид частиц характеризуется определенным значением константы кислотности или основности. У многоосновных кислот имеются отдельные константы для каждого образующегося иона. Из табл. 14.4 можно взять константы для фосфорной кислоты и ее ионов: Очевидно, что сила кислоты быстро уменьшается по мере увеличения отрицательного заряда соответствующей частицы. По теории Аррениуса написанные… Читать ещё >
Сила кислот и оснований (реферат, курсовая, диплом, контрольная)
Силу кислот и оснований в водном растворе согласно протолитической теории устанавливают относительно стандартной кислоты — иона гидроксония Н30+ и стандартного основания — иона гидроксида ОН". Для этого надо рассмотреть протолитические реакции кислоты и основания с водой. По отношению к кислоте вода играет роль основания, а по отношению к основанию — роль кислоты. В качестве примера возьмем кислоту и основание, составляющие сопряженную пару:
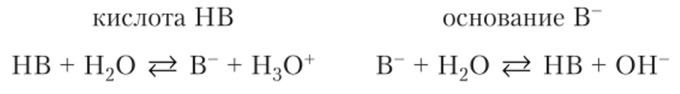
Напишем выражения для констант равновенсия. При этом учитываем, что вода как растворитель присутствует в большом избытке и ее молярная доля в растворе может считаться равной единице.

Написанные константы называются соответственно константой кислотности и константой основности. Численно Ка и Кь совпадают с константами диссоциации по теории Аррениуса. Чем больше константа, тем сильнее соответствующая кислота или основание. Легко понять, чему равно произведение написанных констант. Одинаковые концентрации в числителе и знаменателе сократятся, и мы получим:
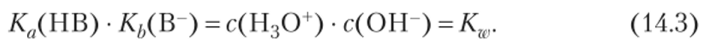
Это соотношение подтверждает обратную пропорциональность между силой кислоты и сопряженного основания. Значения констант приводятся в справочных таблицах (табл. 14.4). Для сопряженной пары обычно дается константа кислотности. Соответствующая константа основности может быть вычислена по формуле (14.3). В практических расчетах вместо констант Ка и Кь широко используют их силовые показатели рКа и рКь:
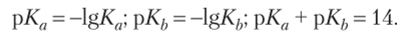
Для сильных кислот (основаниий) значения Ка (Kh) значительно превышают единицу и для расчетов используются редко, так как сильные кислоты практически полностью депротонируются, а сильные основания полностью протонируются. Иначе говоря, для сильных кислот и оснований протолитическая реакция с растворителем оказывается практически необратимой.
Таблица 14.4
Константы кислотности для сопряженных кислотно-основных нар
(при 25 °С)
Название кислоты. | Сопряженная пара. | к, | рК". |
Серная. | H2S04/HS04 | — 3. | |
Гидроксоний-ион. | н3о+/н2о. | — 1,74. | |
Азотная. | HN03/NOJ. | — 1,32. | |
Хлорноватая. | НСЮз/СЮз. | ||
Г идросул ьфагион. | HSCV SOJ; | 1,0−10-2 | 1,99. |
Фосфорная. | Н3РО4/Н2Р04; | 6,9 10-3 | 2,16. |
Фтороводородная. | HF. | 6,3−10-4 | 3,2. |
Азотистая. | hno2/no2 | 5,6−10-4 | 3,25. |
Муравьиная. | нсоон/псоо. | 1,8? 10—4 | 3,75. |
Уксусная. | CH3COOH/CH3COO. | 1,75 -10—5 | 4,756. |
Угольная. | С02 + Н20/НС0з^. | 4,5−10-7 | 6,35. |
Сероводородная. | H2S/HS; | 8,9−10-7 | 7,05. |
Дигидрофосфат-ион. | н2ро4/ НРО|; | 6,2 I0-8 | 7,21. |
Хлорноватистая. | нсю/сю. | 4 -10-8 | 7,40. |
Аммоний-ион. | nh4+/nh3 | 5,6 -10—10 | 9,25. |
Цианистоводородная. | 1ICN/CN. | МО-9 | 9,00. |
Г идрокарбонат-ион. | НСО3/ cof. | 4,7−10-" . | 10,33. |
Гидрофосфат-ион. | нро427 РО|; | 4,8 Ю-13 | 12,32. |
Вода. | н2о/он; | 1,8−10-16 | 15,74. |
Аммиак. | NH3/NH2; | МО-23 |
Каждый вид частиц характеризуется определенным значением константы кислотности или основности. У многоосновных кислот имеются отдельные константы для каждого образующегося иона. Из табл. 14.4 можно взять константы для фосфорной кислоты и ее ионов:
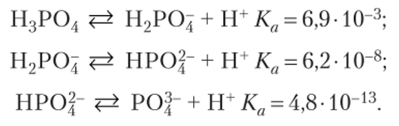
Очевидно, что сила кислоты быстро уменьшается по мере увеличения отрицательного заряда соответствующей частицы. По теории Аррениуса написанные константы назывались бы константами диссоциации по первой, второй и третьей стадиям.
К табл. 14.4 следует дать еще некоторые пояснения. Протолитические реакции с растворителем будут практически обратимы, если константы кислот находятся в пределах между константой гидроксония (Ка = 55) и константой воды (Ка= 1,8 -10″ 16). Поэтому серная кислота (Ка= 1000) практически полностью денротонируется, и молекул H2S04 в растворе не остается. Напротив, аммиак (Ка = 1 • 10~23) в водном растворе не проявляет кислотных свойств, так как его константа на семь порядков меньше, чем /С"(Н20).