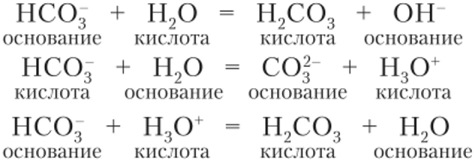Среда растворов солей.
Гидролиз иона

Среда раствора определяется первой ступенью гидролиза. Гидролиз по второй ступени протекает очень незначительно, а по третьей почти не проходит — из раствора хлорида железа не выпадает осадок очень малорастворимого тригидроксида железа Fe (OH)3, из-за того что образовавшиеся по первой ступени ионы водорода Н+ смещают равновесие второй и третьей ступеней гидролиза влево. Так как большинство… Читать ещё >
Среда растворов солей. Гидролиз иона (реферат, курсовая, диплом, контрольная)
Взаимодействие ионов с водой — явление, очень широко распространенное в природе и играющее огромную роль как в технологии, так и в быту. От чего зависит pH океанских и речных вод, крови человека, газированной воды? Почему пекарские порошки поднимают тесто? На многие подобные и другие вопросы отвечает гидролиз ионов, или, как неточно говорят, гидролиз солей.
Водные растворы солей в зависимости от природы образующих их кислот и оснований могут быть кислотными, основными и нейтральными. Так, растворы хлорида аммония NH4C1, хлорида железа FeCl3 или сульфата алюминия A12(S04)3 имеют кислотную среду. Растворы ацетата натрия NaCH3COO, ацетата кальция Са (СН3СОО)2, карбоната натрия Na2C03 (сода) имеют основную среду.
Кислотность раствора хлорида железа FeCl3 настолько велика, что в нем цинк растворяется с выделением водорода, как в растворе соляной кислоты. А растворы ацетата аммония NH4CH3COO, хлорида натрия NaCl (поваренная соль), сульфата натрия Na2S04 почти нейтральны.
Кислотность или основность водных растворов солей связана с протеканием в них гидролиза. В широком смысле гидролиз — это любое взаимодействие вещества с водой. Ниже пойдет речь о гидролизе как реакции иона соли с водой. Гидролиз — процесс, обратный реакции нейтрализации.
Так как большинство солей — сильные электролиты и находятся в водном растворе в виде ионов, то уравнения реакции гидролиза следует записывать сокращенными молекулыю-ионными уравнениями как реакцию между ионом и молекулой воды. Среда раствора соли зависит от того, какой электролит — слабая кислота или слабое основание — образуется в реакции иона с водой.
Для правильной записи уравнения реакции гидролиза и последующего расчета pH раствора пользуйтесь следующей последовательностью действий.
- 1. Напишите уравнение диссоциации соли на ионы.
- 2. Определите, какой из ионов может взаимодействовать с водой с образованием слабого электролита и ионов водорода или гидроксида.
- 3. Уравнение реакции запишите по ступеням, если ион двухи более зарядный. В каждой ступени участвует одна молекула воды! Чаще всего гидролиз определяет среду раствора при его прохождении по первой ступени.
- 4. Сделайте вывод о среде раствора.
Цинк в растворе сульфата железа Fe2(S04)3 растворяется так же, как в растворе кислоты. Раствор Fe2(S04)3 имеет сильную кислотность благодаря гидролизу иона железа. Напишем уравнение диссоциации соли: 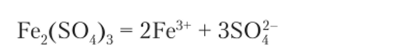
Уравнение гидролиза по первой ступени записывается так:
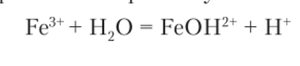
Образующиеся ионы водорода обусловливают кислотную среду раствора (pH < 7). Реакция протекает главным образом по первой ступени, хотя гидролиз может проходить по следующим ступеням.
Соль Fe2(S04)3 образована трехкислотным основанием Fe (OH)3. Поэтому гидролиз иона железа протекает в три ступени. Образовавшийся по первой ступени ион FcOH2+ реагирует по второй ступени с еще одной молекулой воды: 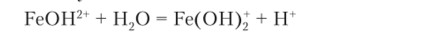
Реакция проходит и по тоетьей ступени:
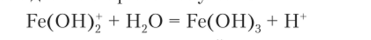
Среда раствора определяется первой ступенью гидролиза. Гидролиз по второй ступени протекает очень незначительно, а по третьей почти не проходит — из раствора хлорида железа не выпадает осадок очень малорастворимого тригидроксида железа Fe (OH)3, из-за того что образовавшиеся по первой ступени ионы водорода Н+ смещают равновесие второй и третьей ступеней гидролиза влево.
Чтобы гидролиз прошел по второй и третьей ступеням, следует равновесие сместить вправо. Это можно сделать, удалив ионы водорода Н+ из сферы реакции, для чего достаточно ввести гидроксид-ионы ОН приливанием раствора гидроксида натрия, что приводит к образованию слабого электролита — воды Н20. Уравнение полного гидролиза таково:
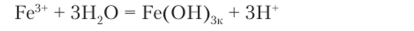
Реакция, смещенная вправо гидроксид-ионами, записывается следующим образом: 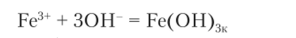
Обычно (в других учебниках) принято представлять уравнение с участием молекул:
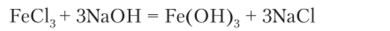
Однако реакция, но такому уравнению проходит не в растворе, а между кристаллическими веществами.
Помните: в уравнении гидролиза иона должна быть записана одна формула воды!
Гидролиз иона NH3 (раствор хлорида аммония NH4CI) записывается уравнением 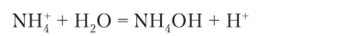
Образующийся ион водорода обусловливает кислотную среду раствора (pH < 7).
В растворе ацетата натрия NaCH3COO среда основная (pH > 7) вследствие гидролиза ацетат-иона:
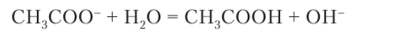
Раствор сульфида натрия Na2S имеет основную среду (pH > 7) благодаря гидролизу сульфид-иона:

По второй ступени уравнение записывается так:
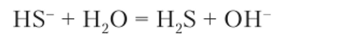
По ней реакция протекает незначительно, что связано с медленным уходом из раствора сероводорода (запах) и смещением равновесия реакций вправо. Чтобы реакция прошла по второй ступени, в раствор добавляется раствор кислоты.
Уравнение гидролиза кислотного аниона, например, в растворе гидрокарбоната натрия ЫаНСОя имеет вид.
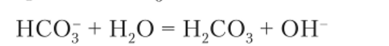
Образование неустойчивой угольной кислоты приводит к тому, что уже при слабом нагревании начинается выделение из раствора углекислого газа (тесто с добавленным пекарским порошком «поднимается»).
Соль может быть образована слабыми основанием и кислотой, например ацетат аммония CH3COONH4. Тогда протекает гидролиз сразу двух ионов: 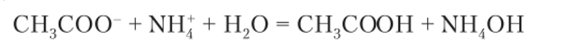
Среда раствора почти нейтральная, слабокислотная или слабоосновная в зависимости от силы образовавшихся слабых кислоты и основания.
Соль, образованная сильными кислотой и основанием, например NaCl или NavS04, гидролизу не подвергается, но среда раствора может незначительно отклоняться от нейтральной в связи с ионной силой раствора и ее влиянием на активности ионов.
Гидролиз ионов, несмотря на простоту уравнений, — очень сложный процесс, состоящий из многочисленных последовательных и параллельных реакций (стадий) с образованием ионов сложного состава.
Мы обсудили гидролиз ионов, который проходит в природных условиях при растворении различных минералов или в результате попадания в воду выбрасываемых отходов производства или быта.
Гидролизуются не только ионы, но и многочисленные другие вещества, в частности органические. Например, гидролизуется карбамид (мочевина) NH9-CO-NH" продукт белкового обмена у животных и человека, под действием фермента уреазы:
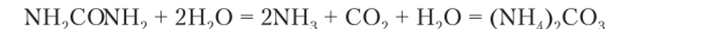
Эта реакция проходит в сточных водах и обусловливает их буферные свойства (см. ниже).
Рассчитаем pH 0,01 М раствора сульфида натрия Na.;S. Константа гидролиза сульфид-иона по первой ступени равна 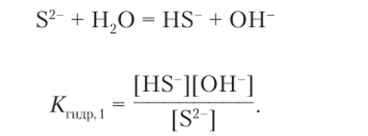
Концентрация воды в константу равновесия не входит, так как она в разбавленном растворе постоянна. Это выражение преобразуем дважды.
Преобразование 1. В соответствии с уравнением реакции концентрации гидросульфид-иона и гидроксид-иона равны: [HS-] = [ОН-]. Концентрацию сульфид-иона можно считать равной концентрации соли: [S2-] = Ссоль. Поэтому.
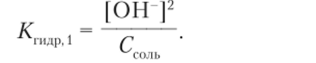
Преобразование 2. Умножаем числитель и знаменатель на концентрацию того из ионов [Н ] или [ОН ], который с имеющейся в числителе концентрацией другого иона дает ионное произведение воды Кп. В данном случае умножаем числитель и знаменатель на концентрацию ионов водорода и получаем новое выражение константы гидролиза:
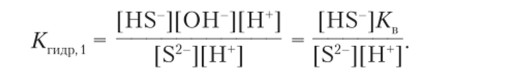
[HS].
В этой константе член г? 2? есть не что иное, как обратная.
I ^ I [ Н |.
константа диссоциации гидросульфид-иона:
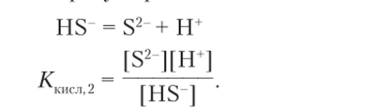
Учитывая это, запишем окончательную формулу константы гидролиза:
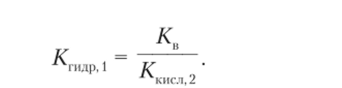
Согласно формуле, чем меньше константа диссоциации кислоты (или основания), тем больше константа гидролиза, тем сильнее смещено равновесие реакции гидролиза вправо и тем выше основность (кислотность) раствора, т. е. меньше (больше) значение pH.
Отсюда Объединяем результаты двух преобразований выражения константы гидролиза:
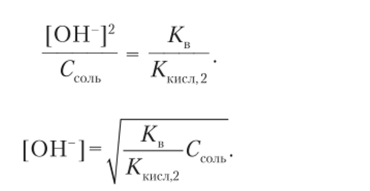
Константы диссоциации сероводородной кислоты и гидросульфид-иона по справочным данным равны:
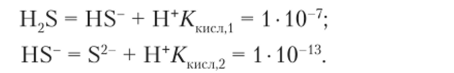
Обратите внимание: в выражение константы гидролиза по первой ступени входит константа диссоциации кислоты по второй ступени. Поэтому в 0,01 М раствора сульфида натрия pH вычисляется следующим образом:
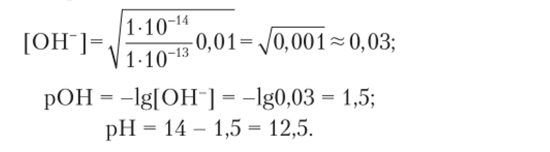
Среда раствора сульфида натрия — основная.
Приближенно концентрация ионов водорода в растворе соли, образованной слабыми кислотой и основанием, например в растворе ацетата аммония CH3COONH4, рассчитывается следующим образом. Уравнение реакции гидролиза 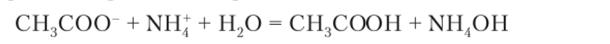
Так как количества ионов водорода и гидроксид-ионов определяются константами диссоциации кислоты и основания, то отношение концентраций ионов соответствует отношению констант диссоциации:
Отсюда получаем 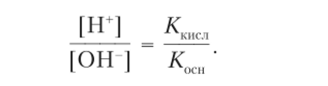
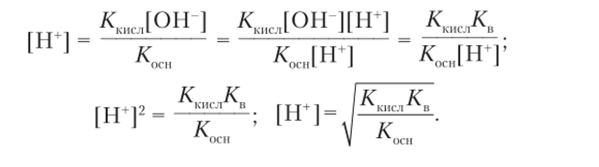
Среда раствора ацетата аммония слегка слабокислотная (pH = = 6,9), так как константа диссоциации уксусной кислоты Кшсл = = 1,86−10 5 немного превосходит константу диссоциации гидроксида аммония Кжп = 1,79 -10 5. В отличие от других вариантов гидролиза ионов в этом приближенном способе расчета концентрация ионов водорода и pH раствора не зависят от концентрации соли.
Выражение константы гидролиза включает ионное произведение воды и константы диссоциации образующихся слабых электролитов. Так как при повышении температуры ионное произведение воды в значительно большей степени возрастает по сравнению с константами диссоциации слабых кислот и оснований, то при повышении температуры константа гидролиза возрастает и равновесие гидролиза смещается вправо, в сторону продуктов (гидролиз сопровождается поглощением теплоты, АII > 0). Нагреванием удается сместить равновесие гидролиза вправо.
С практической точки зрения важно знать о среде растворов фосфатов. Раствор фосфата натрия Na3P04 имеет основную реакцию (0,1 М, pH ~ 12), что объясняется гидролизом фосфат-иона:
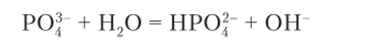
Раствор гидрофосфата натрия Na9HP04 имеет более слабую основную среду раствора (0,1 М, pH ~ 9,5), что объясняется одновременным протеканием двух реакций:
1) гидролиз иона HPOJ": 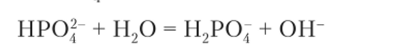
2) диссоциация иона НРО? как слабой кислоты:
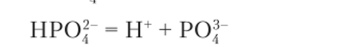
Количество ионов ОН", образующихся по первой реакции, превосходит количество ионов водорода, образущихся по второй реакции, и среда раствора слабооснбвная.
Раствор дигидрофосфата натрия NaH2P04 имеет кислотную среду раствора (0,1 М, pH «4,5), что объясняется преимущественно диссоциацией кислотного иона Н., Р04:
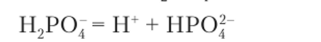
Следовательно, при определении среды таких растворов, как разнозамещенные фосфаты натрия, необходимо учитывать как гидролиз кислотного (или основного) иона, так и его диссоциацию.
Рассмотренный выше сокращенный молекульно-иониый способ написания уравнений гидролиза, 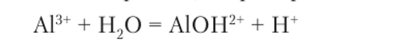 например для иона алюминия удобен для вычисления pH раствора. Однако в водном растворе катионы гидратированы, причем связь шести ближайших молекул воды с катионом довольно высока, и уравнение гидролиза правильнее записывать так:
например для иона алюминия удобен для вычисления pH раствора. Однако в водном растворе катионы гидратированы, причем связь шести ближайших молекул воды с катионом довольно высока, и уравнение гидролиза правильнее записывать так:
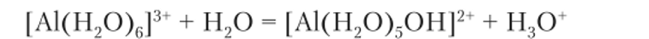
Координационное число 6 иона алюминия в этом процессе сохраняется. Можно записать это уравнение по-другому, если вместо формулы иона оксония написать формулу иона водорода:
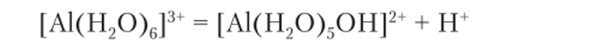
Это уравнение отражает не реакцию гидролиза, а диссоциацию комплексного иона [А1(Н20)б]3+ как слабой кислоты. Далее:

Этот пример показывает, что одно и то же явление может быть объяснено по-разному в зависимости от наших знаний и целей описания.
Часто смещение равновесия гидролиза вправо вызывается удалением продуктов реакции. В лабораторной практике и в природе гидролиз проходит в открытых системах. Гидролиз, сопровождающийся уходом продуктов реакции из зоны реакции (газ или осадок), часто условно называют полным (или необратимым) гидролизом (но не в термодинамическом смысле!).
Сульфид алюминия Al2S3 в водном растворе не существует. Получить его взаимодействием ионов алюминия и сульфид-ионов не удается. При сливании растворов хлорида алюминия и сульфида натрия выпадает осадок гидроксида алюминия А1(ОН)3 и выделяется сероводород H2S. Сульфид алюминия можно получить реакцией между металлическим алюминием (опилки, порошок) и серой (порошок). Если полученное кристаллическое вещество Al2S3 поместить в воду, протекает реакция гидролиза:
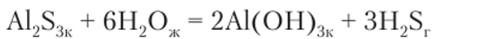
При сливании растворов хлорида алюминия и сульфида натрия проходит реакция с образованием тех же продуктов:
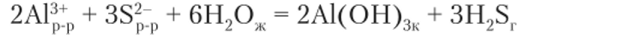
Обе реакции — примеры полного гидролиза.
По протонной теории кислот и оснований Брёнстеда гидролизующийся ион в зависимости от того, какие вещества образуются, играет роль или кислоты, или основания: