Практикум.
Химия

Получение основной соли. Гидроксид кобальта (П) — нерастворимое вещество розового цвета, основная соль кобальта — синего цвета. Налейте в пробирку 5—7 капель раствора сульфата кобальта CoS04 и прибавьте пять капель раствора NaOH. Отметьте цвет полученной основной соли (CoOH)2S04. Напишите уравнение реакции. Оксиду кобальта соответствует нерастворимый гидроксид, поэтому его нельзя получить… Читать ещё >
Практикум. Химия (реферат, курсовая, диплом, контрольная)
Контрольные вопросы и задания.
- 1. Дайте определения основным классам неорганических соединений (оксиды, основания, кислоты, соли).
- 2. Приведите классификацию и уравнения реакций, характеризующие свойства оксидов.
- 3. Приведите классификацию и охарактеризуйте общие химические свойства кислот.
- 4. Приведите классификацию и охарактеризуйте общие химические свойства оснований.
- 6. Приведите уравнения реакций, описывающие химические свойства и способы получения солей.
- 7. Приведите примеры реакций соединения, разложения, обмена, замещения. Отметьте, какие из них относятся к окислительно-восстановительным реакциям.
Примеры выполнения упражнений.
1. Укажите, к какому классу принадлежат следующие неорганические соединения, дайте им название по систематической номенклатуре: NaH2P04, НСЮ2, Ni203, BeO, HBr, Mn (OH)2, (NH4)2S04.
Решение.
NaH2P04 — кислая соль — дигидрофосфат натрия, НС102 — кислородсодержащая кислота — хлористая кислота,.
NiO — основный оксид — оксид никсля (П),.
ZnO — амфотерный оксид — оксид цинка, ПВг — бескислородная кислота — бромоводородная кислота, Мп (ОН)2 — основание — гидроксид марганца (И).
- (NH4)2S04 — средняя соль — сульфат аммония.
- 2. Напишите уравнения реакций, характеризующие химические свойства ВеО и НС104.
Решение.
1. ВеО — амфотерный оксид не растворяется в воде, взаимодействует с кислотами и щелочами, а также при сплавлении с основными и твердыми кислот! I ы м и оке идам и:
ВеО + 2НС1 = ВеС12 + Н90.
ВеО + 2NaOH + Н20 =Na2|Be (OH)4|.
ВеО + СаО —СаВе02 ВеО + Si02 —U BeSi03
- 2. НС104 — хлорная кислота проявляет общие химические свойства кислот, т.с. изменяет окраску индикаторов, взаимодействует с основаниями, основными оксидами, амфотерными оксидами и гидроксидами, солями, металлами:
- 2НСЮ4 + Са (ОН)2 = Са (СЮ4)2 + 2Н20 2НСЮ4 + СаО = Са (СЮ4)2 + Н20 2НСЮ4 + ZnO =Zn (Cl04)2 + Н20 2НСЮ4 + Zn (OH)2 = Zn (C104)2 + 2Н20
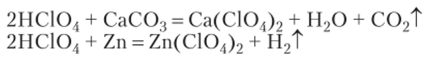
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Со —> СоО —> Со (ОН)2 —> СоС12.
Решение.
1. Данное задание направлено на актуализацию знаний о классах неорганических соединений и их генетических связях. Необходимо написать соответствующие реакции и расставить коэффициенты.
Для получения из кобальта его оксида необходимо окислить металл кислородом:
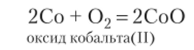
- 2. Оксиду кобальта соответствует нерастворимый гидроксид, поэтому его нельзя получить непосредственно реакцией с водой. Необходимо растворить оксид в сильной кислоте, а затем из раствора полученной соли осадить нерастворимый гидроксид реакцией со щелочью:
- а) СоО + H2S04 = CoS04 + Н20
- б) CoS04 + 2КОН = Со (ОН)24 + k, so4
гидроксид кобальта (П).
3. Получить соль из гидроксида кобальта (П) можно реакцией нейтрализации с соответствующей кислотой:
Со (ОН)2 + 2НС1 = 2Н20 + СоС12
хлорид кобальта (Н).
4. Приведите уравнения реакций получения NaCl всеми известными вам способами.
Решение. NaCl — хлорид натрия можно получить прямой реакцией между металлом и неметаллом, а также реакциями замещения — действием металла на кислоту и действием хлора на соль менее активного галогена: 2Na + Cl2 = 2NaCl 2Na + 2НС1 = 2NaCl +H, T Cl2 + 2NaI = 2NaCl + 2l~
Можно получить соль с помощью реакций обмена между кислотой и щелочью, кислотой и основным оксидом, а также реакциями солей с кислотой, щелочью и между солями:
NaOH + НС1 = NaCl + Н20 Na20 + 2НС1 = 2NaCl + Н20 Na2C03 + 2IIC1 = 2NaCl + 11,0 +CO, t 2NaOH + CuCl2 = 2NaCl + Cu (OH)2l Na, S04 + BaCl2 = 2NaCl + BaS04i.
Задания для самостоятельного решения.
1. Укажите, к какому классу принадлежат следующие неорганические соединения, дайте им название по систематической номенклатуре.
Вариант. | Формулы неорганических соединений. |
Cu (OH)2, С02, А1203, HN ()3, ВаС12, Fe2(S04)3, КОН, НВг. | |
Cr (OH)3, НС1, SO, Н:)Р04, FeO, СО, Са (ОН)2, KN03 |
Вариант. | Формулы неорганических соединений. |
MgS03, Ва (ОН)2, S03, PbO, II2Si03, Al (OH)3, Nal, Li2(). | |
FeOHCl2, P205, CaCl2, NO, HC1, BaO, H3P04, SrCO:i | |
N02, Sr (OH)2, Mg (N03)2, HI, Cr203, ZnS, H2S03, Fe (OH)2 | |
Cr03, NaOH, HN02, PbS ()4, Na2(), I IF, AlOHS04, N2(). | |
Fe203, HBr, LiOH, PbCl2, Na2Si03, H2C03, P203, Mg (OH)2 | |
C02, CuOH, H2S, NaHC03, Be (OH)2, Mg3(P04)2, HC104, ZnO. | |
CH3COOK, Ag2(), H2Se, NaOH, N2()5, Cu (OH)2, CaHC03, K2(). | |
H3PO3, NH4N03, Zii (OH)2, MgS, CaO, C1207, HBrO, BeO. | |
HMn04, Se03, NH4OH, CoO, MgC03, RbOH, SnCl2, K2S04 | |
KHS ()4, Si ()2, FeS, Mo ()3, CsOH, Mn (OH)2, H2Cr04, HBr. | |
KMn04, HC102, As205, Rb20, AgN03, H3B03, Al (OH)3, LiOH. | |
V205, NaII2P04, II3As04, Sc203, Ga (01I)3, AlBr3, Pb (OII)2, IIF. | |
CuS04, NaHS, Mn207, B203, H2Mn04, Ni (OH)2, H2Se, Sn (OH)2 |
2. Напишите уравнения реакций, характеризующие химические свойства предложенных веществ.
Вариант. | i. | |||||||
Вещества. | CaO. HN03 | co2 Ba (OH)2 | A1203 HC1. | ci2o7 NaOH. | MgO. H2so4 | so2 Ca (OH)2 | k2o. HBr. | ZnO. HI. |
Вариант. | ||||||||
Вещества. | S03 Fe (OH)3 | p2o5 Cr (OH)2 | Fc203 H2s. | BaO. н2со3 | Si02 Sr (OH)2 | n2o3 KOH. | CuO. h3po4 | |
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения.
Вариант 1.
Zn —> ZnO —^ ZnS04 —> Zn (OII), —> ZnO Вариант 2.
P —^ P203 —? H3PO4 —> Na3P04 —> Ca3(P04),.
Вариант 3.
Ca ?—^ Ca () —> Ca (OH)2 ?—^ Ca0O3 —? CaCl2 Вариант 4.
S -> S02 -> S03 -> H2S04 -> BaS04 Вариант 5.
Mg -> MgO ^ Mg (N03)2 Mg (OH)2 MgO Вариант 6.
N -«NO -> N02 -> HN03 -> Al (N03)3
Вариант 7.
Ва —> ВаО —> Ва (ОН)2 —> ВаС12 —> BaS04 Вариант 8.
С —> СО, —> Н2С03 —> Na2C03 —> СаС03 Вариант 9.
Si Si02 -> K2Si03 -> H2Si03 -> Si02 Вариант 10.
Fe Fe203 -> FeCl3 -> Fe (OH)3 -> Fe203 Вариант 11.
Al -> A1203 -> Al (N03)3 -> Al (OH)3 -> A1203 Вариант 12.
Li —^ Li, О —? LiOH —> Li2S04 —> LiCl Вариант 13.
Cr -> Cr203 Cr (N03)3 ->• Cr (OH)3 -> Cr203
Вариант 14.
Sr -> SrO -> Sr (OH)2 -> Sr (N03)2 -> SrS04 Вариант 15.
C1207 -> HC104 ->? Са (СЮ4)2 -> CaC03 C02
4. Приведите уравнения реакций получения следующих веществ всеми известными вам способами.
Вариант. | ||||||||
Вещество. | BaS04 | CuCl2 | к3ро4 | NaN03 | СаСОэ | ZnS. | PbCl2 | KBr. |
Вариант. | ||||||||
Вещество. | CuS. | ВаС03 | PbS04 | Na, S. | MgC03 | CaS04 | Ca3(P04)2 | |
Тест для самоконтроля.
- 1. Какое вещество относится к кислотным оксидам?
- 1) А1203;
- 2) Мп267;
- 3) NO?
- 2. Какое вещество относится к амфотерным оксидам?
- 1) СаО;
- 2) Мо03;
- 3) Сг203.
- 3. С каким веществом ZnO не будет взаимодействовать?
- 1) NaOH;
- 2) HCI;
- 3) н2о.
- 4. С каким веществом NaOH не будет взаимодействовать?
- 1) С02;
- 2) А1(ОН)3;
- 3) N, 0.
- 5. С каким веществом будет взаимодействовать соляная кислота?
- 1) Na2S04;
- 2) AgN03;
- 3) KN03.
- 6. Действием кальция на какое вещество нельзя получить соль СаС12?
- 1) НС1;
- 2) СиС12;
- 3) С12.
- 7. С каким веществом разбавленная серная кислота не будет взаимодействовать?
- 1) Си;
- 2) СиО;
- 3) (Cu0H)2S04.
- 8. Какое вещество является средней солью?
- 1) NaHC03;
- 2) MgOHCl;
- 3) NH4N03.
- 9. С каким веществом Сг (ОН)3 не будет взаимодействовать?
- 1) Na2S04;
- 2) H2S04;
- 3) NaOH.
- 10. Какое вещество может вытеснить олово из раствора SnCl2?
- 1) Си;
- 2) Мп;
- 3) Са.
Ответы к тесту
Номер вопроса. | ||||||||||
Номер ответа. |
Лабораторная работа № 2 Классы неорганических соединений
Цели работы: изучить основные способы получения и химические свойства основных классов неорганических соединений — оксидов, оснований, кислот и солей.
Реактивы: Na (металлический); СаО; Р205; СиО (порошок); мрамор (СаСОэ); 2 н растворы: НС1, H2S04, NaOH; 0,5 н растворы: NiS04, ВаС12, ZnS04, Ва (ОН)2, Pb (N03)2, KI, CoS04; Са (ОН)2 (насыщ.); растворы индикаторов: фенолфталеин, метилоранжевый, лакмус.
Оборудование: стеклянный стакан на 250 мл, фильтровальная бумага, пинцет, скальпель, микрошпатель, штатив с пробирками, аппарат Киппа, газовая горелка или спиртовка и спички, держатель для пробирок, кристаллизатор с водой.
Ход работы Опыт 1. Окраска индикаторов в различных средах.
В три пробирки до 1 /3 их объема налейте: в первую — раствор соляной или серной кислоты, во вторую — дистиллированную воду, в третью — раствор едкого натра. В каждую из пробирок добавьте по две капли раствора лакмуса. В следующие три пробирки с растворами тех же веществ прилейте по две капли раствора фенолфталеина. В следующие три пробирки с такими же растворами добавьте по две капли метилоранжа. Проследите, как изменяется окраска индикаторов в растворах кислоты, щелочи и в дистиллированной воде. Результаты наблюдений запишите в таблицу.
Индикатор | Окраска индикатора. | ||
б растворе кислоты. | в дистиллированной воде. | в растворе щелочи. | |
Лакмус. | |||
Фенолфталеин. | |||
Метилоранж. | |||
Опыт 2. Получение и свойства оснований.
- 1. Взаимодействие металлического натрия с водой (демонстрируется преподавателем). Налейте в стакан емкостью 250 мл до 1 /2 его объема дистиллированной воды. Добавьте несколько капель фенолфталеина. Небольшой кусочек натрия внесите в стакан с водой. Наблюдайте выделение водорода. По окончании реакции в полученный раствор добавьте две капли фенолфталеина. По изменению окраски индикатора определите, какое вещество получилось в результате реакции. Напишите уравнение реакции.
- 2. Взаимодействие основного оксида с водой. Внесите в пробирку один микрошпатель оксида кальция СаО, прилейте 2—3 мл дистиллированной воды, содержимое пробирки энергично встряхните и дайте отстояться. В отстоявшийся раствор добавьте две капли фенолфталеина. По изменению окраски индикатора определите, какое вещество получилось. Напишите уравнение реакции.
- 3. Взаимодействие соли со щелочью. В пробирку налейте одну пипетку раствора сульфата никеля NiS04 и прилейте 2—3 капли 2 н раствора едкого натра NaOH. Отметьте цвет полученного осадка. Напишите уравнение реакции.
Опыт 3. Получение и свойства кислот.
- 1. Взаимодействие кислотного оксида с водой. Налейте в пробирку 1—2 мл дистиллированной воды и внесите один микрошпатель Р205. В полученный раствор добавьте две капли раствора лакмуса. Какими свойствами обладает полученный раствор? Напишите уравнение реакции.
- 2. Взаимодействие соли с кислотой. Налейте в пробирку одну пипетку раствора хлорида бария ВаС12 и добавьте раствор серной кислоты до образования осадка. Отметьте цвет осадка. Напишите уравнение реакции.
Опыт 4. Получение амфотерного гидроксида и исследование его свойств.
В две пробирки налейте, но две капли 2 н раствора (см. гл. 7) гидроксида натрия NaOH, затем в каждую пробирку по каплям добавьте раствор сульфата цинка ZnS04 до образования осадка.
Проверьте отношение полученного гидроксида Zn (OH)2 к растворам кислоты и щелочи, для чего разлейте осадок на две пробирки, в одну пробирку добавьте раствора НС1, а во вторую — раствора NaOH до растворения осадка. Какими свойствами обладает полученный гидроксид цинка? Напишите соответствующие уравнения реакций.
Опыт 5. Получение солей.
- 1. Взаимодействие гидроксида бария с серной кислотой {реакция нейтрализации). В пробирку налейте гидроксид бария Ва (ОН)2 и столько же раствора серной кислоты H2S04. Отметьте цвет осадка полученной соли. Напишите уравнение реакции.
- 2. Взаимодействие кислотного оксида с основанием. Налейте в пробирку до 1/3 ее объема раствора Са (ОН)2 и пропустите С02 из аппарата Киппа до образования белого осадка карбоната кальция СаС03. Напишите уравнение реакции. Содержимое пробирки сохраните для следующего опыта.
- 3. Получение кислой соли. В пробирку с осадком, полученным в предыдущем опыте, продолжите пропускать С02 до полного растворения осадка вследствие образования растворимой соли Са (НС03)2. Напишите уравнение реакции.
. Взаимодействие основного оксида с кислотой. Внесите в пробирку один микрошпатель СиО, прилейте 2—3 пипетки раствора H2S04 и нагрейте на слабом пламени горелки до появления голубой окраски раствора. Напишите уравнение реакции.
- 5. Взаимодействие солей. Налейте в пробирку 5—7 капель раствора нитрата свинца Pb (N03)2 и прилейте четыре капли раствора иодида кадия (KI). Отметьте цвет полученного осадка. Напишите уравнение реакции.
- 6. Получение основной соли. Гидроксид кобальта (П) — нерастворимое вещество розового цвета, основная соль кобальта — синего цвета. Налейте в пробирку 5—7 капель раствора сульфата кобальта CoS04 и прибавьте пять капель раствора NaOH. Отметьте цвет полученной основной соли (CoOH)2S04. Напишите уравнение реакции.