Практикум.
Химия

В пробирку с тремя каплями раствора нитрата ртути (П) добавьте по каплям раствор иодида калия до образования осадка ярко-оранжевого цвета — иодида ртути (Hgl2). Затем в эту же пробирку добавьте еще раствора иодида калия до полного растворения осадка иодида ртути. Образовавшийся желтоватый раствор соответствует раствору комплексного соединения ртути (П) — тетраиодомеркурата (П) калия. Напишите… Читать ещё >
Практикум. Химия (реферат, курсовая, диплом, контрольная)
Контрольные вопросы.
- 1. Изложите основные положения теории Вернера.
- 2. Чем объясняется способность-металлов образовывать комплексные соединения?
- 3. Объясните механизм образования связей между ионом-комплексообразователем и лигандами, между внешней и внутренней сферами.
- 4. Изложите правила номенклатуры комплексных соединений.
- 5. Опишите диссоциацию комплексного соединения. Дайте определение константы нестойкости комплексного иона.
- 6. Охарактеризуйте химические свойства комплексных соединений.
Примеры выполнения заданий.
1. Укажите: а) заряды комплсксообразователя, лигандов и комплексного иона; б) координационное число комплексообразователя; в) названия соединений: 1) [Ni (NH3)4]S04; 2) [Cr (NH3)5(CNS)l (N03)2; 3) H2[PtCl6]; 4) К2[Hg (CN)3(CNS) |; 5) [Pt (NH3)2Cl4|; 6) | Fe (NO)2(CO)2].
Решение.
- 1. [Ni (NH3)4]S04 — сульфат тетраамминникеля (П); S04~ — анион внешней сферы (по заряду и числу ионов внешней сферы определяют заряд комплексного иона); [Ni (NH3)4]2+ — комплексный катион; NH3 — лиганд; Ni2+ — катиоп-комплексообразователь, его координационное число равно 4.
- 2. [Cr (NH3)5(CNS)|(N03)2 — нитраттиоцианатопснтаамминхрома (III); [Cr (NH3)5(CNS)]2+ — комплексный катион; NH3 и CNS- — лиганды; Сг3+ — ион-комплексообразователь, его координационное число равно 6.
- 3. Н2| PtCl6| — гексахлороплатинат (1У) водорода; | PtCl6|2_ — комплексный анион; С1- — лиганд; Pt4+ — ион-комплексообразователь, его координационное число равно 6.
- 4. K2[IIg (CN)3(CNS)] — трицианотиоцианатомеркурат (П) калия (меркуратами называют анионные комплексы ртути: mercunus — латинское название ртути, принятое у алхимиков); [IIg (CN)3(CNS)][1]~ — комплексный анион; Hg2+ — ион-комплексообразователь, его координационное число равно 4; CN- и CNS- — лиганды.
- 5. [Pt (NH3)2CI4] — тетрахлородиамминплатина (1У); комплексное соединение без внешней сферы содержит электронейтралы 1ый комплекс; Pt4+ — ионкомплексообразователь с координационным числом 6; NH3 и С1- — лиганды.
- 6. [Fe (NO)2(CO)2] — дикарбонилдинитрозилжелезо; Fe° — агом-комплексообразователь с координационным числом 4; молекулы N0 и СО лиганды.
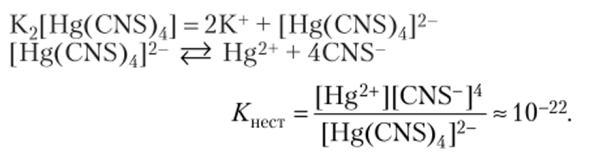
3. Опишите характер связей и пространственное строение комплексного иона в соединении K3[CoF6].
Решение.
У иона Со3+ на внешней оболочке имеются вакантные 4s-, Ар- и 4гУ-орбитали:

г. р т.
Фторид-ионы имеют неподеленные пары электронов: l. J .
При взаимодействии F- и Со3+ образуется комплексный ион [CoF6]3_, в котором шесть лигандов F- образуют шесть ковалентных связей по донорно-акцеторному механизму:
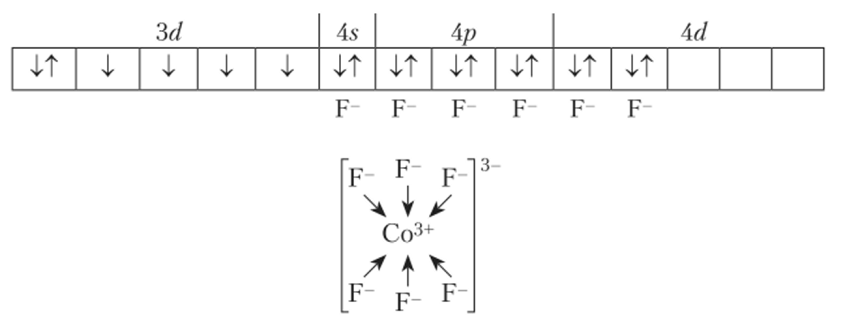
При образовании комплекса происходит х/?3с/2-гибридизация и соответственно полученный комплекс имеет октаэдрическую структуру.
Связи, образующиеся между внешней и внутренней сферой, — ионные.
4. Составьте молекулярные и ионные уравнения возможных процессов, объясните их направленность, подпишите названия комплексных соединений:

Решение. Протекание обменных реакций, в которых участвуют комплексные ионы, подчиняется общему правилу обменных процессов: они идут в сторону более полного связывания ионов. Это достигается при образовании труднорастворимых веществ с низкими значениями ПР или слабых электролитов (в частности, комплексных ионов) с низкими значениями Кж (Кнесг комплексных ионов).

ПР образующегося вещества Ag2S значительно ниже Кнеп. исходного комплексного иона, ион-комплексообразователь связывается сульфид-ионами в осадок сульфида серебра, над которым концентрация ионов серебра меньше, чем в исходном растворе.
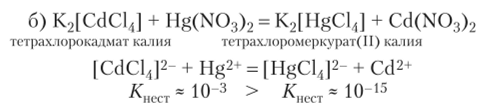
В згой реакции исходный комплексный ион разрушается, превращаясь в новый, более прочный (произошла замена комплексообразователя — катиона кадмия на катион ртути).
в) В следующей реакции исходный комплексный ион превращается в более прочный путем замены лигандов:
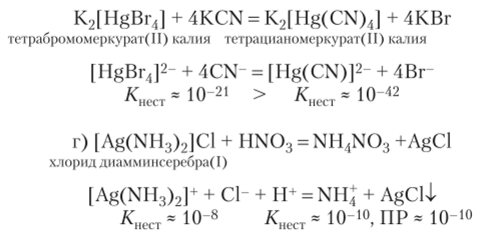
Исходный комплексный ион разрушается, так как его лиганды (молекулы аммиака) образуют с ионами водорода более прочный комплекс — ион аммония, а ион-комплексообразователь образует осадок хлорида серебра.
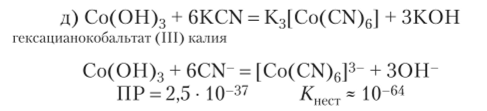
Реакция идет в сторону образования очень прочного комплексного иона, поэтому осадок гидроксида кобальта растворяется.
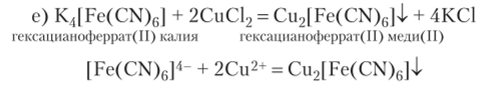
В этой реакции комплексный ион не разрушается, он образует нерастворимое соединение с ионами меди. 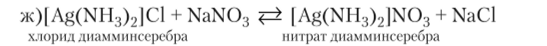
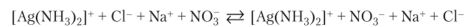
Данная реакция обратима, не идет до конца.
Задания для самостоятельной работы.
- 1. Укажите: а) заряды комплексообразователя, лигандов и комплексного иона; б) координационное число комплексообразователя; в) названия соединений, формулы которых приведены в таблице.
- 2. Опишите характер связей в первом соединении и пространственное строение комплексного иона.
- 3. Приведите уравнения диссоциации второго соединения, напишите выражение константы нестойкости комплексного иона, пользуясь таблицей приложения 11, укажите значение константы нестойкости.
Вариант 1. Na[Ag (CN)2]. [Ag (NH3)2]OH. K,[Cu (CNS)(CN)3]. Na2[Zn (OH)4]. [Fe (H20)6](N03)3. | Вариант 2. [Cu (NH3)4]S04 K2[Cu (CN)4]. [Fe (CO)3]. Na3[Cr (OH)6]. |Co (NH3)3Cl|S ()4 | Вариант 3. K3[Fe (CN)6]. Na2[SiF6]. [Cr (H20), Cl]Cl2 Na3[Ag (S203)2]. K3[Al (OH)6|. |
Вариант 4. [Со (Н20)6]С12 Na3|Co (CN)6]. K2[Sn (OH)4]. [Fe (0H)2(H20)4]Cl. Na[AlI4]. | Вариант 5. Na,[Bc (OH)4]. [Al (0H)(H20)5](N03)2 K4[Fe (CN)6]. NH4[Co (NH3)2(N02)4]. K2[CuI4]. | Вариант 6 | Pt (NH3)4Br2]S04 Cu2| Fe (CN)6| K4[Cd (OIl)6] |Cr (CO)6] |Fe (H20)fi]Cl3 |
Вариант 7 K3[Ag (S203)2] Na3[Cr (OH)6] |Ni (CO)4]. Na2[HgI4|. [Cr (H20)4(0H)2]N03 | Вариант 8 Na[BiI4]. K2[Co (N02)4(NH3)2]. K[Ag (N02)2]. [A1(H20)s(0H)](N03)2 [Pt (NH3)2Cl2]. | Вариант 9. |Mn (Il20)(0H)]2S04 K2[Hg (CNS)4]. |Cu (NH3)4](NO;j)2 H[AuC14]. [W (CO)5]. |
Вариант 10 K2[BcF4]. Na3lCo (CN)6l. [Ti (H20)4(0H)2](N03)2 [Zn (NH3)4](OH)2 K[Au (CN)2]. | Вариант 11. [Ni (NH3)4Cl2]Cl. Na2|PdI4]. Na2[Cd (CN)4]. K[Al (OII)4]. [Zn (H20)3(OH)]Cl. | Вариант 12 Na3[AIF6]. |Ti (H20)5(()H)]Cl3 Na2[CuBr4]. K3[Cr (OII)6]. K2[Hg (CN)4]. |
Вариант 13. [Pt (NH3)2Br4]. |Cr (H20)2(OH)]Cl2 K2[Pb (OH)4]. [Mo (CO)6]. K2| Mn (CN)6]. | Вариант 14. Na2[Mn (OII)6]. Li[AlH4]. K3[Co (N02)6]. [Au (NH3)4J (N03)3 Na2| PtClgj. | Вариант 15. |Co (NII3)5Br]S04 K[A1C14]. Na[BH4]. |Mn (H, 0)3(0H)]N03 K2[Sn (OH)6]. |
4. Составьте молекулярные и ионные уравнения возможных процессов, объясните их направленность, подпишите названия комплексных соединений.
Вариант. | Схема реакции. | Вариант. | Схема реакции. |
K4[Fe (CN)6] + NaOH -> [Co (NH3)6](N03)2 + K2S —> [Zn (NH3)4]S04 + KCNS -? K2[CuCl4] + Hg (N03)2 -> | Na3[Al (OH)6] + HN03 [Ni (NH3)4]S04 + KCN -> K2[HgI4] + Na2S -> Na2[Hg (CN)4] + Co (N03)2 | ||
K3[Ag (S203)2] + NH3 -> K2[HgCl4] + KCN-> Na2[Cd (CN)4] + CuCl2 -> K[Ag (N02)2] + KI ^. | [Ag (NH3)2]N03 + Co (N03)2 K2[Cu (CN)4] + KOH -? [Cd (NH3)4]S04 + NaCN -> [Cu (NH3)4](OH)2 + Na2S -> | ||
K2[HgBr4] + Nal -> [Ag (NH3)2]N03 + KI -> K2[Co (CNS)4] + KCN -> K[Au (CN)2] + AgN03 -> | K2[HgCl4] + KI -" K2[Zn (CNS)4] + Na2S -" [Co (NH3)6]S04 + NiCl2 -" K3[Fe (CN)6] + NaOH ^. | ||
[Cd (NH3)4](N03)2 + KCN —" K[Ag (N02)2] + KI -> K2[SnCl4] + Hg (N03)2 —> K3lAg (S203)2J + NaCl -> | Na2[Co (CNS)4] + K2S -" K2[HgBr4] + NaCN -> Na2[Cu (CN)4] + KOH -? Na2[Co (CNS)4] + Hg (N03)2 -> | ||
[Ag (NH3)2]Cl + Na2S203 K2[CdI4] + Hg (N03)2 Na2[Cu (CNS)4] + K2S -> K2[Cu (CN)4] + NaOH -> | K2[HgBr4] + ZnS04 -> ^аз18(^2®з)2] + ^2^ ~1? [Cd (NH3)4]Cl2 + Co (N03)2 -> [Cu (NH3)4]S04 + NaCN. | ||
K[AuC14] + KCN Na2[Co (CNS)4] + KCN -> [Ag (NH3)2]OH + Nal K4[Co (CN)6] + NaOH -> | Na2[Cu (CN)4] + KCNS -> K2[Co (CNS)4] + Hg (N03)2 -> [Zn (NH3)4]S04 + CuCl2 -> Na[Ag (CN)2] + KC1 -> | ||
K2[PbI4] + Hg (N03)2 -> Na[Au (CN)4] + KC1 -? Na3[Ag (S203)2] + KCN -? Na2[Cu (CN)4] + K2S -> | [Zn (NH3)4] S04 +. + Hg (N03)2 —> K2[HgBr4] + NaCN -> K[Au (CN)2] + KBr -> [Cu (NH3)4](OH)2 + K2S -3. | ||
[Co (NH3)6]Cl3 + Cu (N03)2 -> [Cd (NH3)4](N03)2 + ZnCl2 ->? [Cu (NH3)4]S04 + K2S -? K2[HgBr4] + KCN -> | |||
Тест для самоконтроля.
- 1. В какой молекуле заряд комплексного иона равен -3?
- 1) K4[Fe (CN)6];
- 2) [Cu (NII3)4]S04.
- 3) Na3[Co (N02)6],[2]
- 2)2-;
- 3)1-.
- 3. Чему равно координационное число комплсксообразоватсля в молекуле [Pt (NH3)4Cl2]?
- 1)2;
- 2) 4;
- 3) 6.
- 4. В каком соединении комплексный ион является анионом?
- 1) [Со (СО)6];
- 2) [Ag (NH3)2]Cl;
- 3) К2[Со (Н20)С15].
- 5. Какое вещество будет реагировать с раствором AgN03 с образованием AgCl?
- 1) H2[PtCl6];
- 2) [Pt (NII3)6]C14;
- 3) [Pt (NH3)4Cl2].
- 6. Какова геометрическая конфигурация иона [Cu (CN)4]?
- 1) плоский квадрат;
- 2) тетрадр;
- 3) октаэдр.
- 7. Какова гометрическая конфигурация иона [Co (N02)6]3?
- 1) плоский квадрат;
- 2) тетрадр;
- 3) октаэдр.
- 8. Чему равен заряд иона-комплексообразователя в молекуле K2Na[Co (N02)6]?
" 1) 2+;
- 2) 3+;
- 3) 3-.
- 9. Какое координационное число проявляет ион цинка с зарядом 2+?
- 1)2;
- 2) 4;
- 3) 6.
- 10. Каково правильное название комплексного соединения [A1(0H)(H20)5|(N03)2?
- 1) нитрат гидроксопентаакваалюминия;
- 2) нитрат пентааквагидроксоалюминия;
- 3) нитрат гидроксопентаакваалюминия (Ш).
Ответы к тесту
Номер вопроса. | ||||||||||
Номер ответа. |
Лабораторная работа № 12 Комплексные соединения
Цель работы: изучение реакций образования комплексных соединений ^/-элементов; исследование их свойств.
Реактивы: 0,5 н. растворы CuS04, NiS04, CoCl2, FeCl3, Hg (N03)2, KI, BaCl2, KMn04, K4[Fe (CN)6], (NH4)2S или Na2S, NH3 • H26, NaOH, H2S04.
Оборудование: капельницы с пипетками, штатив с пробирками, спиртовка, спичка, держатель, микрошпатель, стеклянная палочка.
Ход работы
Опыт 1. Образование комплексных катионов d-металлов.
В три пробирки налейте по 10 капель растворов CuS04, NiS04, CoS04 и добавьте в каждую пробирку, но каплям разбавленный раствор аммиака до образования осадка. Отметьте цвета образующихся осадков основных солей и напишите соответствующие уравнения реакций. Затем в каждую пробирку добавьте 25%-ный раствор аммиака до полного растворения осадков в избытке аммиака. Отметьте цвета образовавшихся растворов аммиакатов меди, никеля, кобальта. Напишите уравнения реакций образования соответствующих комплексных соединений, учитывая, что лигандами являются нейтральные молекулы NH3, координационное число Си2+ и Ni2+ — 4, а Со3+ — 6.
Пользуясь значениями констант нестойкости (приложение 11), сравните прочность полученных комплексных катионов. Сине-фиолетовый раствор аммиаката меди сохраните для последующих опытов.
Опыт 2. Образование соединений с комплексным анионом.
В пробирку с тремя каплями раствора нитрата ртути (П) добавьте по каплям раствор иодида калия до образования осадка ярко-оранжевого цвета — иодида ртути (Hgl2). Затем в эту же пробирку добавьте еще раствора иодида калия до полного растворения осадка иодида ртути. Образовавшийся желтоватый раствор соответствует раствору комплексного соединения ртути (П) — тетраиодомеркурата (П) калия. Напишите молекулярные и ионные уравнения образования иодида ртути и его растворения в избытке иодида калия, учитывая, что координационное число IIg2+ равно 4.
Опыт 3. Электролитическая диссоциация комплексных соединений.
- 1. В три пробирки с пятью каплями раствора сульфата меди добавьте по каплям соответственно: раствор щелочи, раствор хлорида бария и раствор сульфида аммония или сульфида натрия до образования осадков. Отметьте их цвет. Напишите молекулярные и ионные уравнения реакций. На основании проведенного опыта составьте уравнение процесса электролитической диссоциации взятой соли меди.
- 2. Сине-фиолетовый раствор аммиаката меди (полученный в опыте 1) разделите на три части. К одной части прилейте 5—7 капель раствора щелочи, к другой — такой же объем хлорида бария, а к третьей — 4—5 капель сульфида аммония (NH4)2S или сульфида натрия Na2S.
От действия каких реактивов выпадает осадок? На присутствие каких ионов в растворе комплексной соли указывает появление осадков? Напишите уравнения соответствующих реакций. На основании выполненного опыта составьте уравнение электрической диссоциации аммиаката меди и его комплексного иона. В каком направлении и почему смещается равновесие диссоциации комплексного иона при действии (NH4)2S?
Объясните, используя данные таблиц приложения 7 и 11, направленность проделанных реакций.
Опыт 4. Окислительно-восстановительные реакции с участием комплексных соединений.
В пробирку с 10 каплями раствора перманганата калия добавьте 5—7 капель раствора серной кислоты, а затем прилейте 10 капель раствора K4[Fe (CN)6].
Напишите уравнение реакции, составьте уравнения полурсакций окисления иона [Fe (CN)6]4_ в ион [Fe (CN)6]3- и восстановления ионов Мп04_ в Мп2+. Как при этом изменяется окраска перманганата калия?
Опыт 5. Использование комплексных соединений для обнаружения ионов Fe3+ в растворе.
В пробирку с 10 каплями подкисленного раствора соли железа (Ш) добавьте 3—5 капель гексацианоферрата (П) калия — K4[Fe (CN)G |. Наблюдайте образование темно-синего осадка берлинской лазури Fe4[ Fe (CN)6]3. Данная реакция является качественной реакцией для обнаружения иона Fe3+. Напишите молекулярное и ионное уравнения реакций образования берлинской лазури. Какой тип гибридизации осуществляется в комплексном ионе [Fe (CN)6]4~?
- [1] Приведите уравнения диссоциации соединений, напишите выражение константы нестойкости комплексного иона: [IIg (NII3)4](N03)2,K2[Hg (CNS)4]. Решение [Hg (NH3)4](N03)2 = [Hg (NH3)4]2+ + 2N03 (сильный электролит). [Hg (NH3)4p Hg2+ + 4NH3
- [2] Чему равен заряд комплексного иона в молекуле соли K2Na[Co (N02)6|?1)3-;