Аммиак.
Химия. В 2 ч. Часть 1. Общая и неорганическая химия

Аммиак — газ с резким удушливым специфическим запахом, легче воздуха, хорошо растворяется в воде (700 объемов в 1 объеме воды). Легко сжижается при увеличении давления или уменьшении температуры, превращаясь в твердое вещество. Легкая сжижаемость связана с тем, что между молекулами аммиака возможно образование водородной связи, с этим же связана и хорошая растворимость аммиака в воде, но в этом… Читать ещё >
Аммиак. Химия. В 2 ч. Часть 1. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
I. Общая характеристика.
Эмпирическая формула (1), структурная (2), электронная (3):
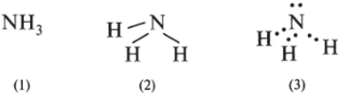
Молекула аммиака имеет форму пирамиды, в ней между атомами водорода и азота реализуется полярная ковалентная связь по обменному механизму; она сигма: s—р; общие электронные пары смещены к атому азота, и на атоме азота локализуется положительный заряд, за счет которого один из атомов водорода одной молекулы втягивается в электронную оболочку атома азота другой молекулы, т. е. возникает водородная связь по схеме:
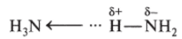
- 6+
- (<——-схема водородной связи; Н—NH2 — схема молекулы аммиака). M (NH3) = 17 г/моль.
II. Физические свойства.
Аммиак — газ с резким удушливым специфическим запахом, легче воздуха, хорошо растворяется в воде (700 объемов в 1 объеме воды). Легко сжижается при увеличении давления или уменьшении температуры, превращаясь в твердое вещество. Легкая сжижаемость связана с тем, что между молекулами аммиака возможно образование водородной связи, с этим же связана и хорошая растворимость аммиака в воде, но в этом случае это связано с образованием водородных связей между молекулами аммиака и молекулами воды. Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом. 7'kohjiNH) = 239,4 К.
III. Химические свойства.
1. Разлагается при нагревании:
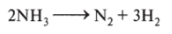
2. Реагирует с кислородом, при этом возможно образование азота, оксида азота (1) и оксида азота (И), а также воды. Практически важно вести процесс так, чтобы происходило образование NO, так как из этого оксида можно получить азотную кислоту, что имеет большое практическое значение. Это возможно, если реакцию вести в присутствии катализатора [платина, оксид хрома (Ш), оксиды ванадия] и при 700 °С:
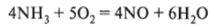
3. При растворении в воде образуется гидрат аммония и частично гидроксид аммония NH4OH, т. е. реализуется равновесие:
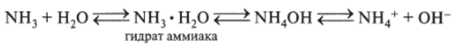
Гидроксид аммония обладает всеми свойствами оснований. Он слабый электролит, реагирует с некоторыми солями, образуя комплексные соединения.
4. Взаимодействует с кислотами, образуя соли аммония:
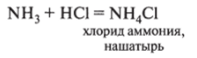
5. Взаимодействует с растворами некоторых солей, образуя комплексные соли:
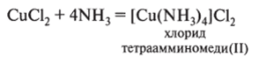
6. Реагируете органическими веществами:
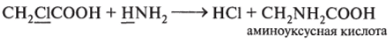
7. Аммиак взаимодействует с некоторыми металлами, образуя в зависимости от условий протекания реакций амиды или нитриды металлов:

8. При высоком давлении и Т= 453 К реагирует с С02, образуя мочевину (карбамид):
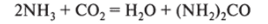
9. Аммиак — активный восстановитель, поэтому способен восстанавливать металлы из оксидов:
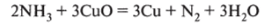
Аммиак может проявлять и другие химические свойства.
IV. Получение.
В лаборатории аммиак получают действием щелочей на соли аммония:
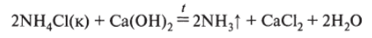
Эта реакция протекает и в растворах при нагревании.
В промышленности аммиак получают синтезом азота и водорода (уравнения и условия протекания см. 9.24, свойство 2). Схема производства аммиака приведена на рис. 9.3.
При производстве аммиака используются следующие принципы научного химического производства: принцип противотока, теплообмена, наибольшей поверхности соприкосновения реагентов, непрерывности процесса, оптимальных условий (температур, давления), использование катализатора, циркуляции (состоит в том, что азот и водород, не вступившие в реакцию, отделяются от аммиака и при помощи циркуляционного насоса возвращаются в колонку синтеза).
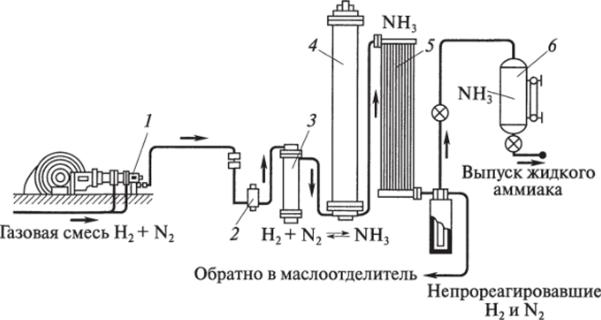
Рис. 9.3. Схема производства аммиака из азота и водорода:
1 — компрессор; 2 — маслоотделитель; 3 — фильтр; 4 — контактный аппарат (колонна синтеза аммиака); 5 — теплообменник (холодильник); б — сборник жидкого аммиака Аммиак можно получить методом цианамидного синтеза. Общая схема процесса:
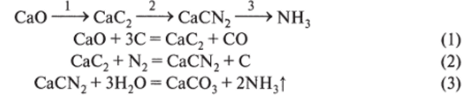
Недостатком этого метода является необходимость использования карбида кальция — довольно дорогого и неудобного в эксплуатации соединения (самопроизвольно разлагается при контакте с атмосферным воздухом за счет взаимодействия с парами воды, содержащимися в нем).
Получают аммиак и при коксовании угля как побочный продукт.
V. Применение, нахождение в природе.
Аммиак находит широкое применение в деятельности человека. Его используют для получения аммиачной воды или нашатырного спирта, применяемого в медицине. Большая часть аммиака используется для синтеза азотной кислоты. Применяют его для получения солей аммония (хлорида, сульфата, нитрата, карбоната аммония, аммофоса). Жидкий аммиак можно использовать как ценное азотное удобрение и для модификации кормов для крупного рогатого скота. Применяют аммиак в производстве мочевины, а также питьевой соды аммиачным способом. Находит применение в холодильной промышленности и других отраслях производства (например, в органическом синтезе и т. д.).
В природе аммиак в свободном виде в больших количествах не встречается. Он получается при разложении мочевины, являющейся продуктом выделения животных и человека, и полностью утилизируется в природных условиях (поглощается природным почвенным поглощающим комплексом или разлагается на азот и водород).
В больших количествах аммиак токсичен для человека и животных, в чем состоит его негативная экологическая роль. Аммиак является источником связанного азота в аммонийной форме, легко усваивается растениями, в чем состоит его позитивная экологическая роль.
- ? Задания для самостоятельной работы
- 1. Поясните, почему молекула аммиака имеет форму пирамиды.
- 2. Поясните, почему аммиак очень хорошо растворяется в воде и легко сжижается.
- 3. Поясните, окислителем или восстановителем является аммиак; обоснуйте свой ответ, проиллюстрируйте его уравнением химической реакции.
- 4. Приведите два обоснованных примера, иллюстрирующих использование аммиака в практической деятельности (в бытовой и в вашей будущей профессиональной деятельности).
- 5. Приведите два обоснованных примера, иллюстрирующих экологическую роль аммиака.