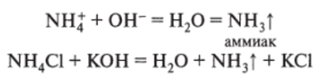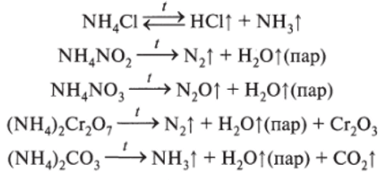К солям, содержащим азот, относят соли аммония, нитриты, нитраты и некоторые комплексные соли. Ниже рассмотрены некоторые вещества из первых трех групп соединений.
Соли аммония
Соли аммония, как правило, являются продуктами взаимодействия аммиака и кислот. Эти соли хорошо растворимы, их химические свойства определяются катионом аммония и анионом кислотного остатка.
Характерной реакцией на катион аммония и его соли является выделение аммиака при действии на соль щелочью; реакция усиливается при нагревании, аммиак идентифицируется по характерному запаху или покраснением влажной синей лакмусовой бумаги: 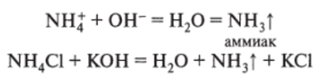
Некоторые соли аммония разлагаются при нагревании:
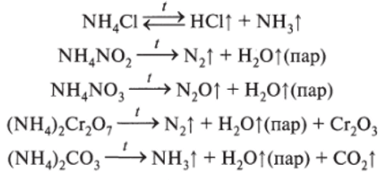
(уравняйте схемы этих реакций).
Рассмотрим некоторые соли аммония, широко применяемые в бытовой и производственной деятельности.
Хлорид аммония (нашатырь) NH4C1 — применяется в технике при паянии, изготовлении «сухих» гальванических элементов; его можно использовать как удобрение, но это нерационально из-за того, что он в своем составе содержит хлорид-ионы, приводящие к засолению почв.
Сульфат аммония (NH4)2S04 — ценное азотное удобрение; уменьшает pH щелочных почв, содержит серу как микроэлемент.
Кислые фосфаты аммония: (NH4)2HP04 — гидрофосфат аммония и NH4H2P04 — дигидрофосфат аммония; их эквимолекулярная смесь (1:1) называется аммофосом и является ценным азотнофосфорным удобрением.
Карбонат аммония (NH4)2C03 —• применяется в кондитерской промышленности как разрыхлитель; можно использовать и как азотное удобрение.
Дихромат аммония (NH4)2Cr207 — сильный окислитель, легко разлагается с образованием оксида хрома (Ш), азота и воды; применяется для получения чистого оксида хрома (Ш), как ингибитор коррозии и т. д.
Известны и другие соли аммония. Все соли аммония используются как реактивы в химических лабораториях.
Аммонийные соли получают взаимодействием аммиака или его водных растворов с кислотами.