Реальные кристаллы.
Твердые фазы переменного состава

Существование в кристаллах вакансий определяет возможность изменения состава кристалла и образования фаз переменного состава. Так. точный анализ показал, что в оксиде железа (II) отношение Fe: О не равно строго единице, а в зависимости от способа получения меняется от FeOi>04 ДО FeOiti2. т. е. в кристалле всегда имеется некоторый избыток атомов кислорода по сравнению с атомами железа. Следует… Читать ещё >
Реальные кристаллы. Твердые фазы переменного состава (реферат, курсовая, диплом, контрольная)
Как любой реальный газ в большей или меньшей мере приближается к идеальному газу, так и реально существующие кристаллы лишь в небольших своих фрагментах приближаются к свойствам идеального кристалла. Во-первых, в идеальном кристалле решетка продолжается бесконечно во все стороны, тогда как размеры реальных кристаллов всегда ограничены. Обычно правильная кристаллическая решетка в любом кристалле реализуется только в сравнительно небольшом объеме, лишь иногда достигающем нескольких кубических сантиметров. Даже абсолютно правильный на вид кристалл состоит из громадного числа небольших фрагментов, линейные размеры которых составляют всего 10−1 000 нм. В каждом из таких фрагментов расположение частиц почти идеально, но сами фрагменты по отношению друг к другу расположены не совсем правильно. Во-вторых, даже в этих «идеальных» фрагментах существуют дефекты структуры. Представление о дефектах в решетке реальных кристаллов очень важно, так как именно через дефекты структуры можно понять свойства кристаллов, такие, как электропроводность и возмож ность диффузии, а также многие процессы в твердых телах: спекание, электролиз, фотографический процесс и т. д. Дефекты могут быть точечными, линейными и поверхностными. Поверхностные и линейные дефекты возникают в местах срастания упомянутых выше фрагментов. Наиболее Рис. 7.15. Дефекты кристаллической решетки:
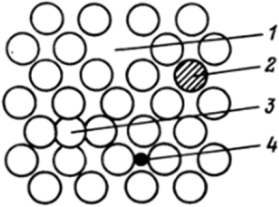
1 — вакансия; 2 — примесь замещения; 3 — частица в междоузлии; 4 — примесная частица в междоузлии важны точечные дефекты, которые существуют в самих фрагментах. Их можно разделить на четыре типа: 1) отсутствие частицы в узле решетки — вакансия в решетке, или, дырка"; 2) частица не в узле, а между узламимеждоузельная частица; 3) в узле решетки посторонняя частица — примесь замещения; 4) посторонняя частица в междоузлии. Все эти типы дефектов показаны на рис. 7.15.
Перемещения междоузельных частиц или частиц из узла в соседнюю вакансию определяют диффузию в кристаллах и электропроводность ионных кристаллов. При этом возможно как перемещение ионов (ионная проводимость), так и перемещение вакансий, что эквивалентно движению ионов в противоположном направлении.
Существование в кристаллах вакансий определяет возможность изменения состава кристалла и образования фаз переменного состава. Так. точный анализ показал, что в оксиде железа (II) отношение Fe: О не равно строго единице, а в зависимости от способа получения меняется от FeOi>04 ДО FeOiti2. т. е. в кристалле всегда имеется некоторый избыток атомов кислорода по сравнению с атомами железа. Следует подчеркнуть, что кристаллическая решетка оксида железа (И) при всех составах одинакова — типа NaCl, т. е. при всех составах мы имеем дело с одной и той же фазой, но состав ее переменный. При недостатке атомов железа часть мест, предназначенных в решетке для этих атомов, остается вакантной. Химическую формулу, например, фазы FeOiti2 правильнее было бы записать так: Fe089D0tllO, где знаком? обозначена вакансия. Эта запись показывает, что в кристалле Fe0112 11% позиций железа вакантны.
Казалось бы, что нарушение стехиометрии должно привести к нарушению электронейтральности кристалла, однако этого не происходит, так как появление вакансий сопряжено с образованием ионов Fe3+. Действительно, 2Fe3* +? = 3Fe2*. Таким образом, возможность частичного замещения ионов Fe2+ на ионы Fe3* в решетке FeO неизбежно приводит к появлению вакансий в позициях железа. В результате оксид железа (II) оказывается соединением (а точнее фазой) переменного состава.
Интервал составов, который может отвечать фазе с определенной кристаллической структурой, называется областью гомогенности. Для различных кристаллов величина области гомогенности колеблется в широких пределах. Например, для сульфида свинца — от PbS0, 9995 Д° PbSj. ooos" а для оксида титана (И) — от TiO0, 59 ДО ТЮ133. Существенно отметить, что кристалл, точно отвечающий составу ТЮ, имеет примерно по 15% вакантных позиций как атомов титана, так и атомов кислорода.
Познакомившись со свойствами твердых веществ, особенно атомных и ионных кристаллов, мы должны вернуться к понятию молекулы.
Напомним, что молекула — это наименьшая частица вещества, обладающая всеми его химическими свойствами. Если твердое вещество представляет собой молекулярный кристалл, то мы вправе сказать, что носителем химических свойств такого вещества являются молекулы. Действительно, в этом случае молекулы, например 12, С02 или UF6, сохраняют свою индивидуальность и определяют свойства вещества и в твердом, и в газообразном, и, как мы увидим дальше, в жидком состояниях.
Но что является носителем свойств твердых веществ, образующих немолекулярные решетки? Какая наименьшая частица обладает свойствами хлорида натрия, оксида железа (II) или кварца? Молекулы NaCl или Si02? Такие молекулы, действительно, существуют в газовой фазе при высоких температурах, но характер химических связей в них совсем иной, чем в кристаллах этих веществ. А значит, и химические свойства молекул NaCl и Si02 не такие, как соответствующих кристаллов. Для того чтобы проявились химические свойства кристаллических NaCl или Si02, должны образоваться уже не молекулы, а кристаллы, т. е. вполне макроскопические количества соответствующих твердых фаз.
Или еще такой пример. Алмаз и графит. С одной стороны, это две кристаллические формы одного элемента углерода. С другой — это безусловно разные вещества. Какая наименьшая частица обладает свойствами алмаза или свойствами графита? На этот вопрос невозможно ответить, так как только очень большая совокупность атомов углерода может расположиться относительно друг друга так, чтобы получилась фаза графита или фаза алмаза.
Таким образом, для веществ, которые образуют решетки, отличные от молекулярных, т. е. атомные, ионные или металлические, носителем их свойств служит не молекула, а фаза. По определению (см. разд. 5.2) фаза однородна во всех своих частях, хотя, как мы видели на примере FeO, может быть неоднородна на атомном уровне. Именно это определяет переменный состав большинства твердых тел.