Восстановительный потенциал.
Общая и неорганическая химия

Возьмем снова ту же систему, включающую две сопряженные пары окислитель — восстановитель Zn2*-Zn и Н* — Н2, но на этот раз разделим их пространственно, как показано на рис. 18.1, поместив в разные сосуды. В первый сосуд с раствором соли цинка опущен кусок металлического цинка, это — цинковый электрод. Чтобы стандартизировать измерения, концентрацию (точнее, активность) ионов Zn2* следует взять… Читать ещё >
Восстановительный потенциал. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
В окислительно-восстановительном процессе принимают участие две пары сопряженных окислителей и восстановителей, и направление реакции между ними определяется тем, какой окислитель и какой восстановитель сильнее. Например, если мы возьмем систему, включающую такие две сопряженные пары, как.
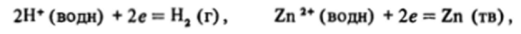
то, в принципе, в такой системе возможна конкуренция за электроны между двумя окислителями — ионами Н* и Zn2*. Если допустить, что первый из них является более сильным окислителем, чем второй, как оно и есть на самом деле, то это означает, что в нашей системе ионы водорода будут окислять цинк, а не ионы цинка — водород. Действительно, мы хорошо знаем, что цинк растворяется в кислоте с выделением водорода и образованием в растворе ионов Zn2*:
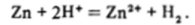
Таким образом, мы заключаем из опыта, что Н* - более сильный окислитель, чем Zn2*, а также, что сопряженный с более сильным окислителем восстановитель Н2 является более слабым восстановителем, чем Zn, сопряженный с более слабым окислителем, т. е. более сильный окислитель всегда сопряжен с более слабым восстановителем, и наоборот.
Мерой силы окислителя должно быть его стремление принять электроны в условиях реакции, т. е. его стремление восстановиться, а мерой силы восстановителя — его стремление отдать электроны. Можно на опыте провести окислительно-восстановительный процесс таким образом, чтобы электроны передавались от восстановителя к окислителю не непосредственно при их столкновении, а через дополнительный проводник — обычную металлическую проволоку.
Возьмем снова ту же систему, включающую две сопряженные пары окислитель — восстановитель Zn2*-Zn и Н* — Н2, но на этот раз разделим их пространственно, как показано на рис. 18.1, поместив в разные сосуды. В первый сосуд с раствором соли цинка опущен кусок металлического цинка, это — цинковый электрод. Чтобы стандартизировать измерения, концентрацию (точнее, активность) ионов Zn2* следует взять равной единице, а внешние условия — температуру и давление — стандартными (298 К и 101 кПа).
Водородный электрод, помещенный во второй сосуд, устроен немного сложнее: газообразный водород под давлением 101 кПа подается на металлический электрод из черненой платины, роль которой заключается в обеспечении проводимости между внешней цепью и раствором, а также в катализе гетерогенного процесса окисления водорода и восстановления водородных ионов. Водородный электрод погружен в раствор кислоты.
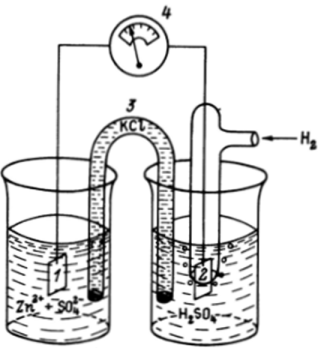
с активностью водородных ионов, равной единице. Между растворами помещен так называемый электролитический ключ, обеспечивающий проводимость, — перевернутая U-образная стеклянная трубка с раствором электролита (скажем, КС1), заткнутая по концам пористым материалом.
Два электрода вместе с электролитическим ключом представляют Рис. 18.1. Гальванический элемент с цинковым (7) и водородным (2) электродами (2 - электролитический ключ; 4 — вольтметр) Рис. 18.2. Компенсационный метод измерения ЭДС гальванического элемента:
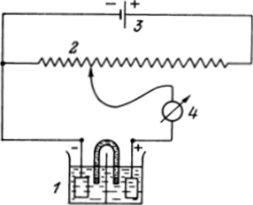
1 — гальванический элемент; 2 — переменное сопротивление; 3 — источник компенсационного тока; 4 — гальванометр собой гальванический элементустройство, способное преобразовывать энергию химической реакции в электрическую. Если соединить металлические части электродов проводником, то цепь будет замкнута, и электроны получают возможность переходить по проводнику от цинка к платине. В стакане с цинковым электродом пойдет процесс.
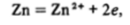
т. е. растворение металлического цинка, окисление его до ионов Zn2*, а в стакане с водородным электродом — восстановление протонов:
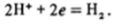
Наш гальванический элемент будет давать ток; цинк будет отрицательным электродом — катодом, водородный электрод — анодом. Разность потенциалов может быть измерена прибором (вольтметром). Реакция будет продолжаться, а ток будет идти по проводнику до тех пор, пока не растворится весь цинк или не израсходуется кислота.
Разность потенциалов подобных элементов можно использовать в качестве меры окислительной способности окислителя и восстановительной способности восстановителя в растворах. Правда, для этого необходимо проводить измерение разности потенциалов (ЭДС элемента) при стандартных условиях (концентрациях и парциальных давлениях), не изменяющихся во времени, т. е. без расходования реагентов — при отсутствии тока в цепи. Этого можно добиться компенсационным методом, приложив навстречу ЭДС элемента равное напряжение от внешнего источника тока (рис. 18.2). Сами стандартные условия определяются, как обычно, следующим образом: концентрации всех участников полуреакции в раствореи исходных веществ и продуктов — 1 моль/л; парциальные давления всех газообразных участников полуреакции над раствором — 101 кПа; твердые вещества в виде самостоятельных чистых фаз.
Таким образом, мы можем измерить значения разности стандартных потенциалов любых электродов, которые можно реализовать на опыте, но принципиально не можем измерить потенциалы отдельных электродов. Для преодоления этого затруднения решено условно принять за нуль потенциал стандартного водородного электрода, а разность потенциалов любого другого электрода и водорода рассматривать как характеристику окислительной способности данного окислителя. За меру окислительной способности окислителя принят его стандартный восстановительный потенциал — стандартный потенциал электрода, включающий пару окислитель-сопряженный с ним восстановитель, по отношению к стандартному водородному электроду.
Полуреакция. | *в, в. | Полуреакция. | Е°, В. |
Li* (водн) + е = Li (тв). | — 3,04. | Fe (CN)J‘ (водн) + е = Fe (CN)J- (водн). | 0,36. |
К* (водн) + е = К (тв). | — 2,92. | 1а (тв)? 2е = 21″ (водн). | 0,54. |
Na* (водн) + е = Na (тв). | — 2,71. | О, (г) + 2Н* + 2е = Н202 (водн). | 0.68. |
Mg2* (водн) + 2е = Mg (тв). | — 2,38. | Ге**(водн) +e = FeJ* (водн). | 0,77. |
Y3* (водн) + Зе = Y (тв). | — 2,37. | Hg2* (водн)? 2е = 2Hg (тв). | 0,79. |
Sc 3* (водн) + Зе = Sc (тв). | — 2,08. | Ag* (водн) + е = Ag (тв). | 0,80. |
Н, ВО, (водн)? ЗН*? Зе = В (тв)? ЗН20. | — 0,87. | 2NO; (водн)? 4Н*? 2е = N204 (г) 4 2НаО. | 0,80. |
Zn2 * (водн)? 2е = Zn (тв). | — 0,76. | N0^ (водн) ЗН* + 2е = HNO, (водн) 4 НаО. | 0,94. |
Fe2* (водн)? 2е = Fe (тв). | — 0.44. | N0; (водн) + 4Н* 4 Зе = N0 (г) 4 2Н, 0. | 0,96. |
Cd7 * (водн) + 2е = Cd (тв). | — 0,40. | Вг2 (ж) 4 2е = 2Вг' (водн). | 1,07. |
Т1* (водн) + е = Т1 (тв). | — 0,34. | Оа (г) 4 4Н* 4 4е = 2Н, 0. | 1,23. |
Snа* (водн) 4 2е = Sn (тв). | — 0,14. | Сг20?'(водн) + 14Н* 4 6е = 2Сг**(водн) 4 7Н20. | 1,33. |
Pb2* (водн) + 2е = РЬ (тв). | — 0,13. | С12 (г) 4 2е = 2СГ (водн). | 1,36. |
2Н* (водн)? 2е = Н2 (г). | 0,00. | НСЮ + Н* 4 2е" = СГ 4 НЮ. | 1.49. |
S (тв)? 2Н*? 2е = H, S (водн). | 0,14. | Аи3* (водн) 4 Зе = Аи (тв). | U0. |
Sn 4 * (водн)? 2е = Sn7 * (водн). | 0,15. | МпО‘ (водн) 4 8Н* 4 5е = Мп2* (водн) + 4Н20. | 1,51. |
SOJ' (водн)? 4Н* + 2е = H, SO, (водн)? Н, 0. | 0,17. | Се4* (водн) 4е = Се3* (водн). | 1,61. |
AgCl (тв) + е = Ag (тв) + СГ (водн). | 0,22. | О, ,(г)4 2Н* 4 2е = О, (г) 4 Н20. | 2,07. |
Си7 * (водн) + 2е = Си (тв). | 0,34. | Fa (г)? 2е = 2 °F ' (водн). | 2,87. |
Каждой полуреакиии восстановления Ок? пе = Восст соответствует свой стандартный восстановительный потенциал. Например, для полурсакции.

или кратко ^2n[1]/Zn = «0[2]76 Это означает, что Zn2[2] как окислитель слабее, чем Н[2]. и что Zn как’восстановитель сильнее, чем Н3. Отсюда вывод металлический Zn должен растворяться в кислоте, вытесняя водород.
Для пары Ag[2]/Ag Е° = 0,80 В. следовательно, ион Ag[2] — довольно сильный окислитель, сильнее, чем Н[2]. Отсюда вывод — серебро не должно растворяться в обычных[2] кислотах, а водород должен восстанавливать ионы серебра до металла.
Значения некоторых стандартных восстановительных потенциалов приведены в табл. 18.1. Диапазон изменений ?[1] простирается от -3,04 В для пары Li[2]/Li до +2,87 для F2/F". Соответственно среди перечисленных веществ металлический литий — самый сильный восстановитель, а газообразный фтор — самый сильный окислитель.
- [1] и нс происходят процессы комплексообразования.
- [2] Кислоты, в растворах которых присутствует только один окислитель — Н2
- [3] Кислоты, в растворах которых присутствует только один окислитель — Н2
- [4] Кислоты, в растворах которых присутствует только один окислитель — Н2
- [5] Кислоты, в растворах которых присутствует только один окислитель — Н2
- [6] Кислоты, в растворах которых присутствует только один окислитель — Н2
- [7] Кислоты, в растворах которых присутствует только один окислитель — Н2
- [8] Кислоты, в растворах которых присутствует только один окислитель — Н2
- [9] и нс происходят процессы комплексообразования.
- [10] Кислоты, в растворах которых присутствует только один окислитель — Н2