Кислотность и щелочность почв

Антропогенные подкисления почв вызываются кислыми продуктами фабричных и заводских отходов, попадающих в атмосферу: хлор и соляная кислота, сероводород и сернистый ангидрид, оксиды азота, соединения алюминия, углекислота. Западноевропейские и скандинавские исследователи отмечают pH атмосферных осадков 4,0, 3,0, 2,0. В создании определенной реакции среды велика роль органических остатков. Лесная… Читать ещё >
Кислотность и щелочность почв (реферат, курсовая, диплом, контрольная)
Природа почвенной кислотности и щелочности
Реакция среды имеет существенное значение для направленности почвенных процессов и уровня почвенного плодородия. Кислотно-щелочные условия зависят от типов почв, их подтиповых, родовых различий и могут колебаться в широких пределах. Черноземы, коричневые почвы, сероземы характеризуются нейтральными условиями. Щелочная реакция наблюдается у солонцов и солонцеватых почв. Кислые условия типичны для почв влажных лесов (подзолистые, серые и бурые лесные, красноземы, желтоземы и др.). Кислотность почвы вызывается ионами водорода. Различают актуальную и потенциальную кислотность.
Актуальная кислотность почв — это концентрация ионов Н+ в почвенном растворе в граммах-эквивалентах (моль) на 1 литр, выражаемая величинами pH, где pH = -lg [Н+].
Чистая вода неэлектропроводна, но тем не менее при 25 °C из одного моля воды диссоциирует на ионы 0,1, или 1(10″ 7, моль воды. Так как число ионов в чистой воде Н+ = ОН", то диссоциацию воды характеризуют ионным произведением:
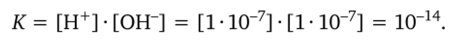
Коэффициент К — константа — показывает, что эта величина не изменяется при любых изменениях количества ионов Н+ и ОН". Допустим, что при добавлении щелочи концентрация ионов ОН" стала равна 10'4, значит концентрация ионов Н+ будет 10'10. Другой случай: добавили кислоту. Концентрация ионов стала 10″ 4, значит концентрация ионов ОН" будет 10~10. Это ионное произведение воды принято обозначать показатлем pH, причем отрицательным логарифмом (степень, в которую возводится 10, записывается с обратным знаком). Пишут: pH = 6. Это значит, что в растворе концентрация [Н+] = 10″6 моль/л и, следовательно, концентрация [ОН-] = 10'8 моль/л, т. е. ионов ОН" в 100 раз меньше, чем ионов Н+. Среда кислая. При pH = 9 концентрация ионов водорода в растворе 10″9, а гидроксид-ионов — 10″ 5, т. е. их в 10 000 раз больше, чем ионов Н+. Среда щелочная. Таким образом, за цифрами показателя pH необходимо научиться видеть и учитывать количество ионов Н+ и дополнительное к нему, согласно ионному произведению воды, количество ионов ОН", представляемое в грамм-эквивалентах (моль) на 1 литр.
Жизнь животных и растений может протекать при pH от 2,5—3 до 10—10,5. За пределами этих концентраций ионов водорода проявление жизни крайне ограничено. Этот же, даже несколько больший, размах pH мы встречаем и в почвах.
Величина pH является наиболее устойчивым генетическим показателем конкретной почвы. Варьирование pH в границах типичных значений составляет 5—10%. Всякое изменение реакции среды приводит к резкой смене характера почвообразования. Ряд почвенных процессов имеет строгую приуроченность к определенным пределам водородного показателя. Это солонцовый процесс, оподзоливание, пептизация и коагуляция коллоидов, ферраллитизация, микробиологические явления и т. д. Антропогенетические изменения pH происходят при окультуривании или деградации почв. Для всех почв величина их pH считается существенным диагностическим критерием.
Потенциальная кислотность — это количество обменных ионов Н+ и А13+ в составе почвенного поглощающего комплекса (ППК), выражаемое в миллиэквивалентах на 100 граммов почвы (мэкв/100 г).
В водной среде происходят следующие реакции:

В результате реакций обмена поглощенные ионы Н+ и А13+ определяют концентрацию ионов Н+ в почвенном растворе, или его pH, т. е. потенциальная кислотность есть скрытая в ППК кислотность.
Потенциальная кислотность разделяется на обменную и гидролитическую. Обменная кислотность проявляется при взаимодействии с почвой нейтральных солей. Обычно для ее определения используют раствор КС1. Образующаяся в растворе кислота оттитровывается щелочью, а сама кислотность выражается в миллиэквивалентах на 100 г почвы. При взаимодействии почв с нейтральной солью не все протоны переходят в раствор, так как в системе устанавливается динамическое равновесие: 
Гидролитическая кислотность обнаруживается при воздействии на почву гидролитически щелочной соли:

Уксусная кислота, как слабогидролизуемая соль, практически связывает все водородные ионы, и происходит практически полное вытеснение протонов из почвенного поглощающего комплекса. Поэтому во всех агромелиоративных расчетах пользуются данными определения гидролитической кислотности для установления доз СаС03 при ликвидации избыточной кислотности. Этот прием называют известкованием почв. В присутствии углекислоты известь переходит в растворимый бикарбонат и происходит необменное поглощение Н+:

Нуждаемость почв в известковании определяют по степени насыщенности почв основаниями, по соотношению между поглощенными Са2+ + Mg2+ и Н+ + А13+.
Эта степень насыщенности почв основаниями выражается в процентах от емкости обмена:

где V — степень насыщенности почв основаниями, %; S — сумма обменных оснований, мэкв/100 г; Е — емкость поглощения, мэкв/100 г; Н — гидролитическая кислотность, мэкв/100 г.
На основании полевых опытов установлено следующая примерная шкала нуждаемости почв в известковании:
- • V ниже 50 — сильно нуждаются в извести;
- • V от 50 до 70 — средненуждаемые;
- • V от 70 до 80 — слабонуждаемые;
- • V выше 80 — не нуждаются в извести.
Различают также актуальную и потенциальную щелочность. Актуальная щелочность почв обусловлена присутствием в почве гидролитически щелочных солей: Ыа2С03, ИаНСОз, Са (НС03)2, 1У^С03, 1У^(НС03)2 и др. Пример реакции, в которую вступают соли, следующий:
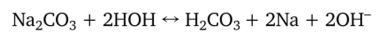
Эти соли увеличивают концентрацию ионов ОН" в почвенном растворе, pH становится щелочной.
Потенциальная щелочность характерна для почв солонцеватых, содержащих обменный натрий:
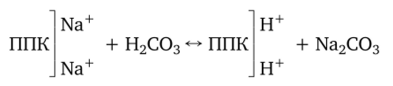
Следовательно, потенциальная щелочность — не что иное, как солонцеватость почв.
Значение солей, встречающихся в почвах, в формировании реакции почвенной среды иллюстрирует табл. 1.26.
Сильнокислую реакцию среды (pH = 2+4) могут создавать при окислении различные сульфиды, которые содержатся в засоленных приморских болотах или отвалах угольных карьеров и шахт:
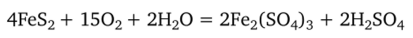
В создании определенной реакции среды велика роль органических остатков. Лесная подстилка подзолистых и серых лесных почв имеет обычно pH = 3,5-^-5,0. Гумусовые же вещества, образующиеся в этой подстилке, более кислы — pH = 3,(НЗ, 5. Особенно кислы продукты разложения мхов — pH = 2,5-^3,0. При разложении растительного опада.
Таблица 1.26
Реакция (pH) растворов соединений, встречающихся в почвах.
Соединения | pH | Соединения | pH |
№2С03 | 12—13 | Са504 | 7,0 |
М?С03 | 11,5 | Н20 | 6,7−7,1 |
СаС03 ббз С02 | 10,2. | N8504, №С1 | 6,5—6,8 |
№НС03 | 8,5—9,5 | Ш4С1 | 4,7 |
Са (НС03)2 | 6,1—8,4 | н2со3 | 3,9—5,7 |
СаС03 + С02 | 8,5 | КА1(8Ю4)2, А1С13 | 2—4. |
в лесных биогеоценозах образуются и свободные органические кислоты типа уксусной, щавелевой, лимонной и др.
Антропогенные подкисления почв вызываются кислыми продуктами фабричных и заводских отходов, попадающих в атмосферу: хлор и соляная кислота, сероводород и сернистый ангидрид, оксиды азота, соединения алюминия, углекислота. Западноевропейские и скандинавские исследователи отмечают pH атмосферных осадков 4,0, 3,0, 2,0.