Термодинамические свойства системы

Где, А — наименьшая площадь, для которой имеет смысл отношение Fnorm/A Ffiorm ~ проекция силы, действующей на поверхность, которая имеет площадь А, на нормаль к этой поверхности. Давление, найденное с помощью этого соотношения, является абсолютным. Абсолютное давление в точке среды связано с высотой столба газа или жидкости над этой точкой z соотношением p = pgz, где р — плотность среды, g… Читать ещё >
Термодинамические свойства системы (реферат, курсовая, диплом, контрольная)
Ранее мы ввели понятие термодинамической системы. Теперь нужно понять, как можно описать ее состояние, если известны свойства системы.
В качестве рабочего тела в термодинамических процессах обычно рассматривают газ или жидкость (флюид). При протекании процессов некоторые свойства часто изменяются, а некоторые остаются неизменными. Например, при закачке газа в баллон изменяются масса, давление и температура газа, но его объем остается неизменным.
С точки зрения термодинамики физическая величина является свойством (функцией состояния), если с ее помощью можно охарактеризовать состояние термодинамической системы.
Например, если термодинамической системой является газ или жидкость (либо смесь газов или жидкостей), в качестве свойств системы можно выбрать массу вещества (веществ), их давления и объемы. Если системой является тонкая пленка, для описания ее состояния нужно знать площадь пленки и коэффициент поверхностного натяжения.
Свойство термодинамической системы — это физическая величина, значение которой зависит от состояния системы и не зависит от истории системы, ее пути в это состояние. Вместо термина «свойство термодинамической системы» часто используют термин термодинамический параметр. Очевидно, что существуют физические величины, которые являются функциями состояния (например, масса, температура, давление, объем), и величины, которые не являются функциями состояния (например, работа или количество теплоты).
Состояние термодинамической системы определяется набором ее свойств. Однако опыт показывает, что не все свойства системы независимы одно от другого. Например, величина электрического сопротивления металлического проводника зависит от температуры. Показатель преломления жидкости зависит от давления и плотности. Таким образом, независимо можно менять только часть свойств системы. Иными словами, состояние системы можно охарактеризовать с помощью конечного числа физических свойств. Если некоторые (независимые) координаты принимают определенные значения, то тем самым задаются значения остальных, зависимых свойств. Выбирая независимые переменные, мы выбираем систему координат. Заданные значения координат определяют состояние системы. Число независимых переменных называют числом степеней свободы системы. Если известны значения независимых переменных, значения остальных (зависимых) переменных можно найти, и тогда состояние системы будет полностью определено.
Если перевести сказанное на язык математики, то получим, что некоторое свойство системы, например объем У, является функцией п независимых свойств Х{у Х2у…, Хп (например, Г, /;), и при этом существует функция.

Независимые переменные Х{, Х2, …, Хп и зависимая величина У образуют систему координат.
Выбор переменных не является произвольным: вначале нужно установить, какие переменные можно рассматривать как независимые, а какие — как зависимые. Соотношение вида (1.1) называется уравнением состояния, а соответствующие переменные (координаты X,) — параметрами состояния или термодинамическими параметрами, переменная У является функцией состояния.
Уравнение состояния получают либо на основании данных экспериментов, либо с использованием теоретических моделей.
Существование уравнения состояния нельзя доказать теоретически. Это гипотеза, основанная на результатах наблюдений. Если термодинамическая система не находится в состоянии равновесия, то в ней происходят превращения энергии и веществ из одной формы в другую, результатом чего является изменение состояния системы. Для описания пути перехода системы из начального состояния в конечное необходимо знать значения параметров системы в каждый момент времени. В термодинамике процесс рассматривается как непрерывная последовательность состояний системы. Следует подчеркнуть, что результат процесса не описывает сам процесс, поскольку одно и то же изменение состояния может быть реализовано бесконечно большим числом способов (путей) (рис. 1.7).
Процесс преобразования тепловой энергии в механическую в тепловых машинах предполагает использование рабочего тела, в качестве которого могут выступать чистые вещества и их смеси в газообразном и жидком состояниях.
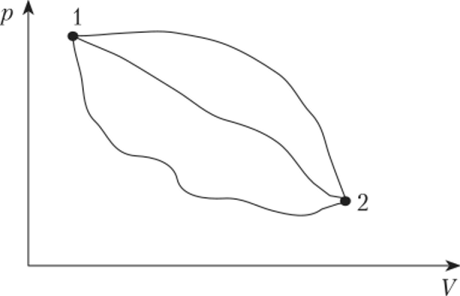
Рис. 1.7. Возможные пути перехода системы из состояния 1 в состояние 2.
Например, газ можно сжимать в цилиндре под поршнем изотермически, адиабатно, с частичным охлаждением или подогревом, обеспечивая при этом эквивалентность начального и конечного состояний. Если известны условия взаимодействия системы (газа под поршнем) с окружающей средой, то в каждый момент времени (в каждой точке процесса) можно определить состояние системы.
В термодинамике анализ процесса часто заменяется анализом состояний термодинамической системы. Например, при анализе процесса сжигания угля в топке задается начальное состояние, давление, количество и соотношение угля и воздуха, вычисляется температура, равновесный состав продуктов сгорания и количество выделившейся теплоты.
Таким образом, важным достоинством равновесной термодинамики является возможность получения результатов процесса на основании информации о координатах начального и конечного состояний термодинамической системы (Д У12 = Y2 — Y{). Конкретный путь перехода системы из начального состояния в конечное часто не имеет значения!
В общем случае изменение состояния происходит вследствие взаимодействия системы с окружающей средой, в частности обмена энергией с окружающей средой (при этом система может отдавать или получать энергию). Если взаимодействие происходит без теплообмена, то в первом случае говорят, что система совершает работу, а во втором — что над системой совершается работа. Параметры, которые описывают взаимодействие системы с окружающей средой, — параметры процесса. Движущая сила процесса может находиться либо в самой термодинамической системе, либо вне ее.
Термодинамика позволяет получить предельные оценки процесса:
- • возможность самопроизвольного протекания процесса в заданном направлении;
- • оценку термической стабильности вещества;
- • максимальную работу, которую можно получить от силовой установки;
- • минимальную работу, которую нужно совершить, чтобы привести в действие энергопотребляющее устройство (насос, холодильник) и т. д.
Термодинамика исследует системы, для которых существует однозначная функция состояния (1.1). При этом значение У не зависит от пути, по которому система попала в состояние (Х{, Х2,Хп). Следует отметить, что существуют системы, для которых эта гипотеза неверна, — это так называемые системы «с памятью».
«Путь» в данном случае не означает перемещения системы в реальном пространстве, речь идет о пути в термодинамическом пространстве, координатами которого являются термодинамические переменные.
Для величин, значение которых не зависит от пути, справедливо соотношение.
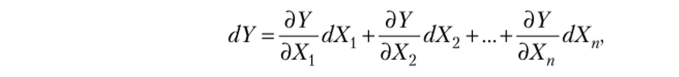
где dY — полный дифференциал. В то же время dY является полным дифференциалом, если.
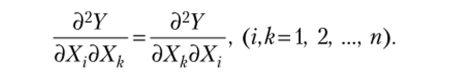
Справедливо и обратное утверждение: если.
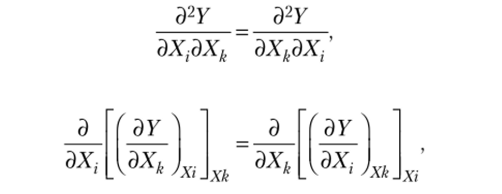
а точнее то значение функции У=/ (Х{, Хъ …, Хп) не зависит от пути. В качестве примера рассмотрим функцию.
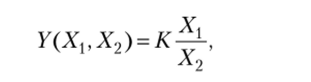
для которой выполняются соотношения 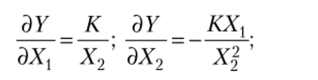
Очевидно, в данном случае У (Xv Х2) — функция состояния.

Все свойства можно разделить на три группы — интенсивные, экстенсивные и удельные.
Интенсивные свойства не зависят от размеров системы в отсутствие полей и не изменяются при разделении системы на части. Если система находится во внешнем поле, то эти свойства являются непрерывными функциями координат: например, в гравитационном поле давление зависит от высоты столба воздуха или жидкости.
Экстенсивные свойства зависят от размеров системы и ее массы. Экстенсивные свойства суммируются при объединении двух или более термодинамических систем. Таким образом, понятие экстенсивности связано со свойством аддитивности. Примерами экстенсивных свойств являются энергия, объем, теплоемкость. В большинстве случаев можно полагать, что экстенсивные свойства зависят от массы, однако, это утверждение справедливо не всегда. В частности, поверхностная энергия зависит от площади, а потенциальная энергия упругой деформации стержня — от его длины.
Аддитивность — свойство величин, состоящее в том, что значение величины, соответствующее целому объекту, равно сумме значений величин, соответствующих его частям, при любом разбиении объекта на части.
Разницу между интенсивными и экстенсивными свойствами можно проиллюстрировать на следующем примере. Если объединить две подсистемы с параметрами (рТ{, V{) и (р2, Т2, V2) соответственно, то объем полученной системы будет равен сумме V{ + V2. Таким образом, экстенсивные величины подчиняются правилу аддитивности. Температура объединенной системы в общем случае не будет равна сумме температур подсистем, интенсивные свойства правилу аддитивности не подчиняются.
Если разделить экстенсивное свойство на массу m вещества системы, получим удельное свойство (х = Х/т) если разделить экстенсивное свойство на количество вещества п, получим молярное свойство.
Удельные величины часто обозначают маленькими буквами, например удельный объем однокомпонентной системы равен отношению объема системы к ее массе, v = V/m, а плотность р = m/V. Чтобы отличить молярные свойства от удельных, их иногда обозначают X. При теоретическом анализе разница между удельными и молярными свойствами зачастую не существенна, поскольку определяется значением одного коэффициента, поэтому в данной книге молярные и удельные свойства обозначаются одинаково, за исключением гл. 16 и 17, в которых молярные свойства обозначаются большими буквами, как это принято в справочниках термохимических величин.
Для определения плотности можно использовать соотношение.
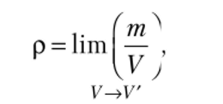
где V — наименьший объем, для которого имеет смысл отношение m/V.
Аналогичным образом определяется давление:
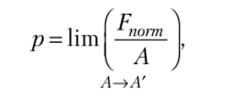
где А — наименьшая площадь, для которой имеет смысл отношение Fnorm/A Ffiorm ~ проекция силы, действующей на поверхность, которая имеет площадь А, на нормаль к этой поверхности. Давление, найденное с помощью этого соотношения, является абсолютным. Абсолютное давление в точке среды связано с высотой столба газа или жидкости над этой точкой z соотношением p = pgz, где р — плотность среды, g — ускорение свободного падения. Если два и более столбов газа или жидкости расположены вертикально один над другим, то абсолютное давление в точке равно сумме давлений каждого столба.
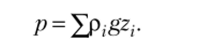
На практике часто приходится иметь дело с избыточным давлением. Избыточное давление — разность между абсолютным и барометрическим давлением. Некоторые манометры показывают именно избыточное давление: Риз6=Ра6с «Ратм;
Единицы измерения давления: 1 Па = 1 Н/м2; 1 бар = 105 Н/м2; 1 атм = = 1,1 325 105 Н/м2; 1 кГс/см2 = 0,980 665-Ю5 Н/м2.
В общем случае интенсивные и удельные свойства — не одно и то же. Например, в некотором диапазоне параметров вода может находиться в равновесии со льдом, в другом диапазоне параметров — в равновесии с насыщенным паром. Свойства каждой фазы различаются между собой, поэтому удельная величина некоторого свойства для всей системы будет отличной от удельных значений этого свойства подсистем при разделении системы на части (рис. 1.8):

Рис. 1.8. К различию понятий «интенсивное» и «удельное» свойства
Вещество находится в определенном фазовом состоянии. Фаза — термодинамически равновесное состояние вещества, однородная (гомогенная) часть системы, все свойства фазы непрерывно изменяются от точки к точке. Иными словами, этот термин используется для обозначения и состояния вещества и области пространства. Гетерогенная система состоит из двух и более фаз. На границе фаз свойства вещества меняются скачкообразно.
Можно показать, что при отсутствии изолирующих перегородок и полей в равновесной системе интенсивные свойства всех фаз одинаковы. При этом удельные свойства фаз могут различаться. Например, обычно плотность резко изменяется при переходе из жидкой фазы в газообразную.
В термодинамике обычно рассматривают гомогенные системы или гетерогенные системы, все фазы которых являются гомогенными. Если протяженная система находится в силовом (гравитационном) поле, ее интенсивные и удельные свойства могут изменяться даже в одной фазе (градиенты давления и плотности в столбе газа или жидкости).
Итак, фаза — однородная часть системы, на границах которой скачкообразно изменяются плотность и другие свойства системы. Отметим, что понятие фазы не следует смешивать с понятием агрегатное состояние (твердое, жидкое, газообразное). Фаза, состоящая из двух и более веществ, называется раствором. Состав раствора характеризуется числами молей веществ или концентрациями. В свою очередь, в качестве единиц измерения концентрации используются:
- • молярная (мольная) доля вещества i — отношение количества вещества i к суммарному количеству всех веществ, входящих в состав раствора, включая растворитель (х, = njns);
- • молярная концентрация вещества г — отношение количества вещества к объему раствора (щ/Ур)
- • моляльность вещества г в растворе — количество растворенного вещества /, отнесенное к массе растворителя (гг, /ms);
- • массовая доля вещества g, = m-J mz.