Окислительно-восстановительные реакции халькогенатных ионов в водных растворах

Ион SOI" как в кислых, так и в щелочных растворах является хорошим восстановителем, а ион SOj" проявляет лишь очень слабые окислительные свойства. Но Вы, конечно, помните, что серная кислота в молекулярной форме, т. е. концентрированная кислота, — довольно сильный окислитель, особенно при повышенных температурах. Необходимо еще учесть, что потенциалы всех переходов более отрицательны, чем Ео /он… Читать ещё >
Окислительно-восстановительные реакции халькогенатных ионов в водных растворах (реферат, курсовая, диплом, контрольная)
Рассмотрим схему восстановительных потенциалов соединений серы и некоторые закономерности изменения потенциалов в ряду S-Se-Te. В стандартном кислом растворе имеем В):
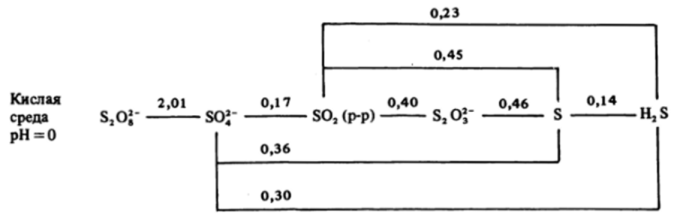
С позиций термодинамики в этих условиях соединения серы должны претерпевать следующие превращения.
Растворенный S02 должен диспропорционировать на ион SOJ" и сероводород или серу:
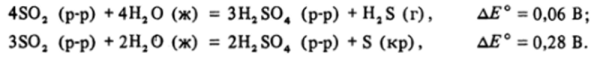
Тиосульфатный анион, в котором сера формально находится в степени окисления +2, диспропорционирует на S02 и серу:
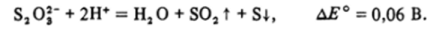
Свободная сера в кислом растворе устойчива по отношению к диспропорционированию :
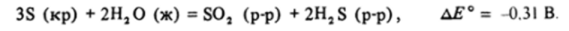
Но отсюда следует, что обратная реакция должна протекать самопроизвольно и сероводород с сернистым газом должны реагировать, образуя свободную серу.
Ион S2Og в кислой среде — сильный окислитель. Он способен окислять воду, и растворы H2S208 должны разлагаться с выделением кислорода: 
Напротив, все остальные вещества, кроме, разумеется, иона SOj", должны окисляться кислородом воздуха. В частности:
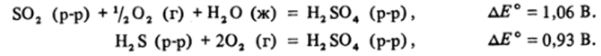
Таким образом, с позиций термодинамики в стандартном кислом растворе, находящемся в контакте с кислородом (воздухом), устойчив только ион SOJ" .
Как Вы помните, в соответствии с уравнением Нернста при увеличении pH положительные значения восстановительных потенциалов уменьшаются. Для соединений серы в стандартной щелочной среде почти все они переходят в отрицательную область (Ещ, В) :
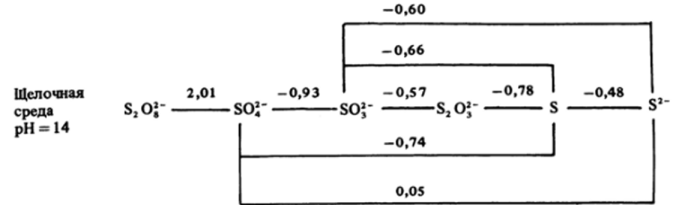
Потенциал перехода S20l""*2S04″ не зависит от pH, и персульфатный ион остается сильным окислителем и в щелочной среде.
Поведение свободной серы в щелочном растворе аналогично поведению хлора — она должна диспропорционировать на ион S2" и ионы S2C>3″, SOf" или SOj" :
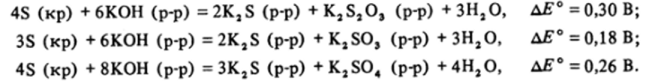
Ион SOf", как и C10J, неустойчив и по отношению к диспропорционированию, и по отношению к воде (в щелочном растворе Е шн о/Н, = = -0,83 В):
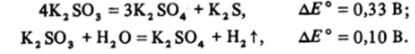
Отметим, что ион S203_ в щелочном растворе не должен диспропорционировать: 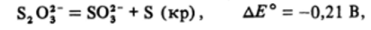
а значит, возможна обратная реакция.
Необходимо еще учесть, что потенциалы всех переходов более отрицательны, чем Ео /он • = в> а значит, кислород должен окислять все соединения серы до иона SO4″. Таким образом, с позиций термодинамики в щелочном растворе, как и в кислом, устойчив только ион SO4″ .
Кинетические факторы ограничивают реальное протекание большинства рассмотренных реакцйй. Так, все реакции с участием свободной серы как реагента при стандартных условиях заторможены. Только при кипячении сера растворяется и в растворе щелочи, и в растворе сульфита. Реакции с участием кислорода имеют высокие энергии активации и при стандартных условиях идут медленно, но все же с заметной скоростью, и поэтому в растворах сульфиты, так же как и сернистая кислота, в присутствии воздуха окисляются до ионов SOJ" .
Подобно хлоратам сульфиты по отношению к диспропорционированию устойчивы даже в кипящих растворах, но при прокаливании солей до ~ 600 °C этот процесс идет:
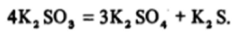
Ион SOI" как в кислых, так и в щелочных растворах является хорошим восстановителем, а ион SOj" проявляет лишь очень слабые окислительные свойства. Но Вы, конечно, помните, что серная кислота в молекулярной форме, т. е. концентрированная кислота, — довольно сильный окислитель, особенно при повышенных температурах.
Для сравнения окислительно-восстановительных свойств соединений серы, селена и теллура сопоставим стандартные потенциалы переходов:
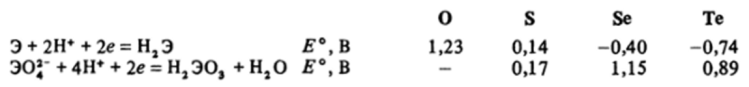
Видно, что в ряду O-S-Se-Te восстановительные свойства халькогеноводородов растут, а значит, окислительные свойства простых веществ убывают.
Окислительные свойства высших кислот максимальны у селеновой кислоты. (Вспомните соответствующие свойства НВг04.) Концентрированная селеновая кислота — очень сильный окислитель.