Разнообразие количественных характеристик состава растворов обусловлено разнообразием практических задач, решаемых на основании этих характеристик.
Рассмотрим некоторые основные способы представления состава растворов.
Массовая доля — отношение массы растворенного вещества к массе раствора. Массовая доля обозначается со и измеряется в долях единицы или в процентах.
Молярная концентрация (молярность) — количество растворенного вещества (число молей) в единице объема раствора. Молярная концентрация в системе СИ измеряется в моль/м3, однако на практике ее гораздо чаще выражают в моль/л или ммоль/л. Обычное обозначение молярной концентрации См, однако она может обозначаться и как М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным и записывают как 0,5 М.
Нормальная концентрация (нормальность) — количество эквивалентов данного вещества в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «Н» или «Лг». Так, раствор с концентрацией 0,5 моль-экв/л называют 0,5-нормальным и записывают как 0,5 Н.
Запишем формулы перехода.
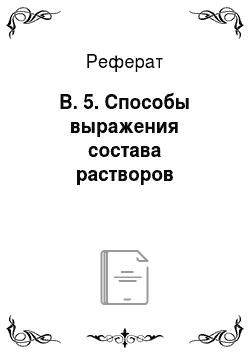
От массовой доли к молярности:
где р — плотность раствора, г/л; со — массовая доля растворенного вещества в долях от 1; М, — молярная масса растворенного вещества, г/моль.
От молярности к нормальности'.
N = Мг,
где М — молярность, моль/л; 2 — число эквивалентности.
Растворимость — количество граммов растворенного в насыщенном растворе вещества, содержащееся в 100 г растворителя.
Состав насыщенных растворов зависит от температуры. Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества заметно меняют свою растворимость в зависимости от температуры, другие — не очень сильно. Если полученные в опытах значения нанести на оси координат, то получаются так называемые кривые растворимости различных веществ (рис. В.1). Эти кривые имеют практическое значение. По ним легко узнать, сколько вещества (например, КИО,) выпадет в осадок при охлаждении до 20 °C насыщенного раствора, приготовленного при 80 °C.
Снимаем точки с графика. При 80 °C в 100 г воды было растворено 160 г КЖ)3, а при 20 °C — 30 г. Исходный раствор имел следующую массу: 100 г воды + 160 г КИОэ = 260 г раствора. После охлаждения раствор будет иметь следующую массу: 100 г воды + 30 г КЖ)3 = 130 г. Следовательно, при охлаждении выпало в осадок 260 — 130 = 130 г КЖ)3.
Некоторые другие характеристики и способы выражения состава растворов будут рассмотрены в соответствующих разделах курса.
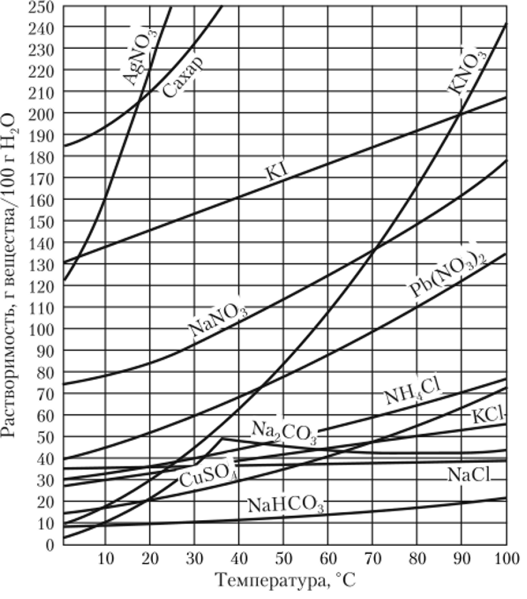
Рис. В. 1. Кривые растворимости.