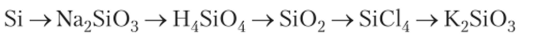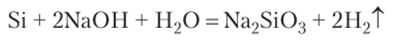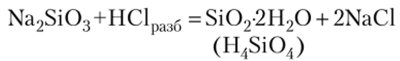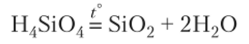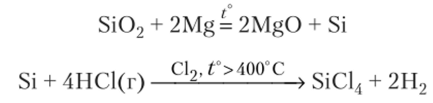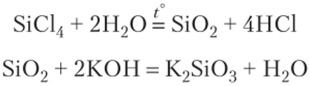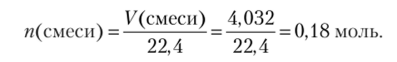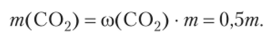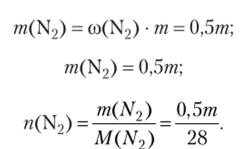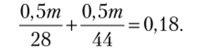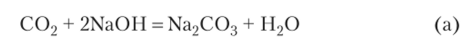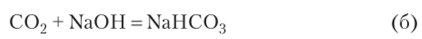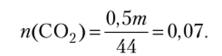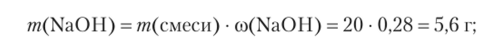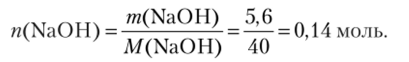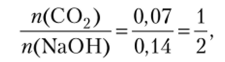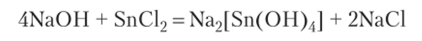Пример 1. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
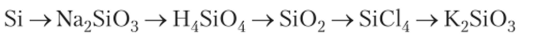
Решение.
1. При сплавлении кремния с щелочью получают силикат натрия:
2. При действии разбавленной соляной кислоты на силикат натрия получают гель кремневой кислоты:
3. При нагревании кремневой кислоты получают оксид кремния (Si02):
4. Для получения тетрахлорида кремния из Si02 его восстанавливают магнием и затем хлорируют:
5. При гидролизе SiCl4 можно получить Si02, который сплавляют с КОП:
Пример 2. Смесь оксида углерода (1У) и азота занимает при н.у. объем 4,032 л. Массовые доли газов в ней равны. Какая соль образуется при пропускании этой смеси объемом 2 л через раствор массой 20 г с массовой долей гидроксида натрия 28%?
Решение.
Определяем общее количество вещества газовой смеси:
Вычисляем массу и количество вещества оксида углерода (1У) в смеси, приняв, что масса смеси равна т, и учитывая, что ®(С02) = = co (N2) = 0,5:
Аналогично получаем:
Так как «(смеси) = h (N2) + п (С02), получаем.
Отсюда находим массу смеси газов: т = 6,16 г.
При пропускании смеси через раствор гидроксида натрия возможна одна из двух реакций. Если С02 в недостатке:
Если С02 в избытке:
Определяем количество вещества С02, содержащегося в смеси:
Рассчитываем массу и количество вещества NaOH в растворе: 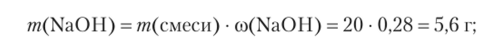
Получаем.
что соответствует уравнению реакции (а). Следовательно, будет образовываться средняя соль — карбонат натрия.
Пример 3. Определите, какой объем 2 н. раствора NaOH необходимо прибавить к 200 г 5%-го раствора SnCI2, чтобы полностью перевести его в станнит.
Решение.
1. Напишем уравнение реакции, соответствующее заданному процессу:
- 2. Рассчитаем массу SnCH в 200 г 5%-ного раствора: т = 200 х х 0,05 = Юг.
- 3. Определим количество молей NaOH (п), необходимое для реакции с 10 г SnCl2, учитывая, что молярные массы NaOH и SnCl2 равны соответственно 40 и 189,6 г/моль: п (NaOH) = 4 х х 40 • ГОД 189,6 • 40) = 0,2 моля.
- 4. Поскольку концентрация раствора NaOH равна 2 моль/л, то 0,2 моля содержится в 100 мл этого раствора.
Ответ: 100 мл.