Закономерности в устойчивости координационных соединений

Устойчивость координационных соединений в большой мере зависит от характера связи М—L. Действуют, прежде всего, факторы, зависящие от свойств комплексообразователя: окислительного состояния, размеров (например, от ионных или ковалентных радиусов), жесткости и др., а также от природы лигандов (донорных атомов), наличия кратных связей и сопряжения и др. Поэтому в настоящем разделе сначала… Читать ещё >
Закономерности в устойчивости координационных соединений (реферат, курсовая, диплом, контрольная)
Устойчивость координационных соединений в большой мере зависит от характера связи М—L. Действуют, прежде всего, факторы, зависящие от свойств комплексообразователя: окислительного состояния, размеров (например, от ионных или ковалентных радиусов), жесткости и др., а также от природы лигандов (донорных атомов), наличия кратных связей и сопряжения и др. Поэтому в настоящем разделе сначала рассматриваются комплексы с ионами металлов, имеющими наибольшие размеры (это редкоземельные элементы) и в максимальной мере ионными связями М—L, а затем прочие комплексы.
Редкоземельные элементы
Логарифмы констант устойчивости lgp однотипных комплексов редкоземельных элементов (РЗЭ) зависят от (1) величины 1/г (г — ионный радиус) и (2) атомного номера.
В первом случае наблюдаются довольно регулярные изменения lgp от обратного ионного радиуса. Это обстоятельство связывают с электростатическим взаимодействием ионов РЗЭ и лиганда. Отмечены три типа зависимостей lgp от 1 /г (некоторые из них показаны на рис. 7.3, 7.4):
- 1. монотонное повышение lgP в ряду РЗЭ;
- 2. монотонное понижение устойчивости комплексов в «иттровой» группе или постоянство lgP;
- 3. сложный, иногда S-образный ход кривой lgp.
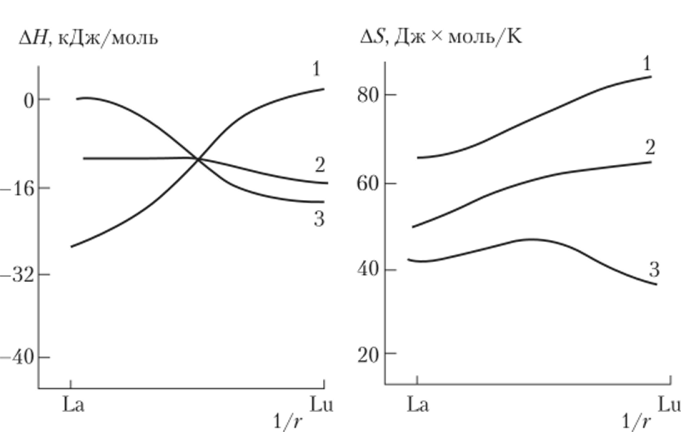
Рис. 7.4. Изменение ЛЯ и AS для (1) моно-, (2) дии (3) трис-
пиколинатов РЗЭ.
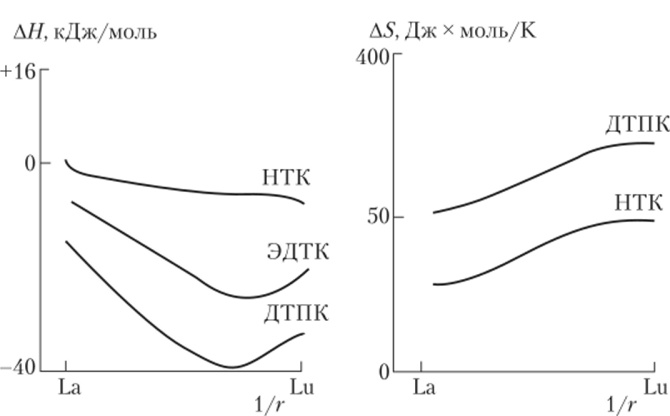
Рис. 7.3. Изменение АЯ и AS для некоторых комплексонатов РЗЭ:
НТК — нитрилотриуксусная кислота, ДТПК — диэтилентриаминиентауксусная кислота Если имеет место преимущественно ионный характер связи М—L, то наблюдается близкая к линейной зависимость lgf3 от 1/г. Отклонения от линейности могут косвенно указывать на изменение типа связи в комплексах или на изменение их структуры. Комплексы иттрия по своим свойствам часто оказываются близкими к комплексам Но—Тш. Однако известны случаи, когда комплексы иттрия по устойчивости располагаются среди элементов «цериевой» группы.
В отличие от корреляций с ионными радиусами зависимости lgP для комплексов от атомного номера существенно сложнее и комплексы разных частей редкоземельного ряда различаются по свойствам.
Впервые вопрос о внутрирядной закономерности для лантанидов был поставлен в 1920—1930;е гг[1]. Многие химики наблюдали заметное изменение свойств в середине ряда РЗЭ вблизи гадолиния, названное гадолиниевым изломом (В. Браунер, В. Клемм[2], И. Ноддак и др.). Имеются в виду, например, проявляемые состояния окисления, ионные радиусы, константы устойчивости, некоторые электрофизические параметры и др. На этом основании 4/-серию делили на две подгруппы. Позднее (1960;е гг.) появились сообщения о наличии несколько более сложных закономерностей. Их зафиксировали, в частности, при анализе величин потенциалов ионизации атомов, констант устойчивости различных комплексных соединений, факторов разделения, энтальпий образования и других характеристик. В соответствии с этим явлением, названным тетрад-эффектом, ряд РЗЭ в действительности разбивается не на два, а на четыре сегмента. Внутри каждого из них обычно наблюдается относительно гладкое изменение свойств соответствующих соединений, а на границах, приходящихся на середину ряда (гадолиний) и на середины каждой половины (Nd—Pm, Но), возможны резкие изменения свойств.
Первыми (1965—1966 гг.) отметили проявления этого эффекта Д. Фиделис и С. Сикерский при анализе констант устойчивости различных комплексов (рис. 7.5)[3], а Д. Пеппард, Г. Мейсон и С. Левей[4] дали название этой корреляции (1968). С. Синха говорил о W— IP-эффекте. Б. Ф. Джуринским (1965) также обнаружена закономерность, фиксирующая области кристаллохимической нестабильности в ряду лантанидов. Она выражается в том, что в особых точках ряда для многих соединений (оксиды, халькогениды и др.) наблюдается изменение характера фазовых диаграмм, изменение типа кристаллической структуры и т. п., причем эффект проявляется статистически. В любом случае идет речь о делении 4/-серии на 4 группы элементов.
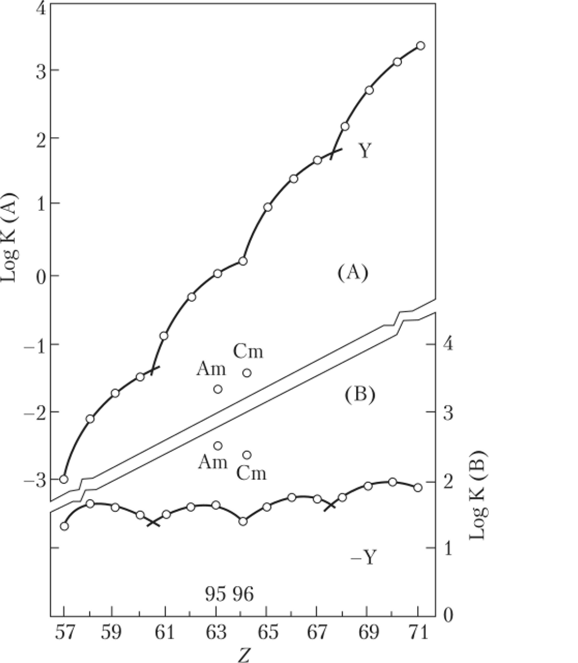
Рис. 7.5. Изменение логарифма константы экстракции (logК) от порядкового номера Ln (III) и An (III):
(А) 0,3 М L, (бензол) от 0,05 М НС1; (В) 0,6 М U (бензол) от 11,4 М LiBr + 0,5 М НВг; L, s ди-м-октилфосфоновая кислота [(fl-C8Hi7)2PO (OH)]; L2? ди-2-этилгексилхлором етилфосфонат [(С1СН2)РО (ОС6Н12С2Н5)2|.
Наиболее четко тетрадный характер изменения свойств в ряду лантанидов проявляется на атомных параметрах (энергиях ионов в газе, в растворе, потенциалах ионизации и т. п., рис. 7.6, 7.7), а именно: наблюдается внутрирядная периодичность типа «резкое изменение — плато — резкое изменение» для каждой половины 4/-серии.
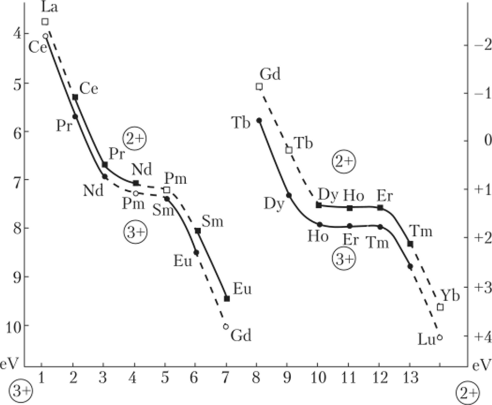
Рис. 7.6. Экспериментальные значения нижних f —> d оптических переходов в ионах Ln2+, Ln3+, стабилизированных в матрице CaF2, от числа d-электронов в электронной оболочке ионов лантанидов.
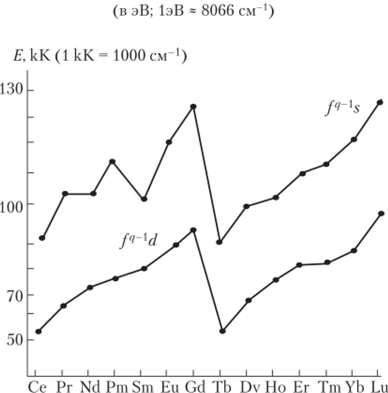
Рис. 7.7. Зависимость энергий возбуждения электронных конфигураций f1 's,/1 'd от порядкового номера редкоземельных элементов Подобные закономерности обнаруживаются и для свойств реальных соединений лантанидов и актинидов разнообразного состава. Правда, проявления тетрад-эффекта здесь достаточно специфичны: в ряду лантанидов для большинства так называемых полных рядов соединений идентичного состава чаще всего фиксируется одна, реже две области кристаллохимической нестабильности, причем заранее неизвестно, на каком конкретно участке лантанидного ряда будет происходить изменение структуры или типа фазовой диаграммы. Иначе говоря, эффект проявляется вероятностно.
Известно множество трактовок этой закономерности.
Например, объясняя «гадолиниевый излом», Дж. Кэтриэл и Р. Понж[5] полагали, что частично заполненные оболочки с большой энергией спин-спаривания имеют меньшие средние радиусы. Следствием этого может явиться то, что заполненная 5/>-оболочка, расположенная вне пределов 4/-оболочки, должна расшириться; это же обеспечивает как бы недостаток одного протона на ядрах гадолиния, давая менее приемлемое центральное поле для 5р-электронов.
Наиболее известны представления К. Йоргенсена[6], который полагал, что причиной таковой является нефелоксетический эффект, хотя, по большому счету, «нефслоксетизм» не объясняет даже качественной картины явления.
Однако, лишь после появления количественной теории[7] стаю ясно, что причина эффекта связана со спецификой изменения в ряду лантанидов (актинидов) параметров, характеризующих межэлектронное отталкивание/-электронов.
Энергия основного терма fq-иона, содержащего q электронов в/-оболочке, выражается уравнением.
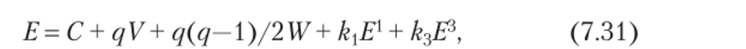
где параметры С, V, W описывают вклад остова, одноэлектронных и сферически симметричной частей двухэлектронного взаимодействия /-электронов, Е Е[7] — параметры Рака, k3 — коэффициенты, связанные с полным спиновым и полным орбитальным моментами. При этом параметры kxE{ и ЕЛЕ[7] характеризуют стабилизацию основного терма относительно центра тяжести /^-конфигурации.
Коэффициенты С, Р, и W в рядах лантанидов и актинидов изменяются монотонно. Однако сумма k{Ex + k^E? зависит от порядкового номера таким образом, что определяет наличие всех имеющихся сингулярностей (резких изменений; см. рис. 7.8) и плато (например, см. рис. 7.7 для энергий электронных состояний fq '.у,.
f" V7).
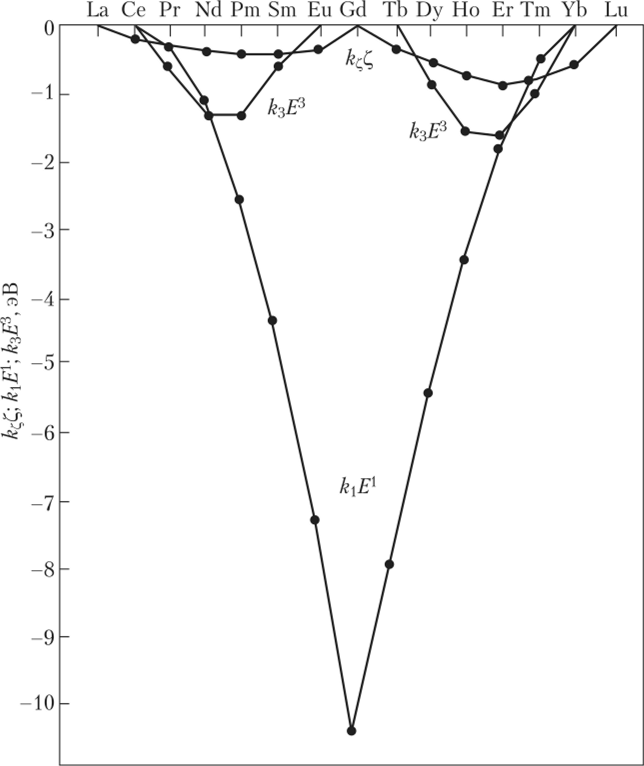
Рис. 7.8. Изменение параметров, характеризующих электростатическое взаимодействие /-электронов Ln111
Эквивалентно относительной стабилизации основных уровней ионов Ln111 (в эВ; 1 эВ = 8066 см ').
Поскольку указанная сумма определяет характер обменного взаимодействия /-электронов, вполне логичен вывод о том, что именно обменное взаимодействие обусловливает наблюдаемую периодичность.
Особенностью эффекта является то, что значимость его в серединах каждой половины серии различается. Более сильно он действует в середине второй половины серии элементов, что обусловлено влиянием конденсированного состояния. Этот эффект был обнаружен[10] при рассмотрении термодинамики комплексов трехи четырехвалентных РЗЭ. Оказалось, что разность энергий решетки LnmF3 и LnIVF4, или M3LnlvF7 и M3LnmF6 (At/), а также разности соответствующих энтальпий образования (ДЯ°) связаны с четвертым потенциалом ионизации атомов лантанидов (/4) следующим соотношением.

Значения AU в ряду лантанидов изменяются «гладко» и так, что для второй половины 4/-серии они заметно больше, чем для первой. Поскольку зависимость величин /4 от порядкового номера элемента нелинейна и подчиняется тетрад-эффекту, то аналогично изменяются и значения ДН° (ДG°).
Уравнение (7.32) в полной мере действует лишь для преимущественно ионных связей металл—лиганд. При наложении эффектов ковалентности (например, в форме обменных взаимодействий в твердых соединениях) относительно слабо выраженные особые точки в середине каждой половины рядов /-элементов могут терять специфичность. Учитывая, что такие параметры, как коэффициенты разделения, энергии экстракции, константы устойчивости и т. п., имеют ненулевую погрешность, трудно ожидать, что последнее не будет сказываться на суждении о наличии или отсутствии закономерности.
Отметим также, что во многих комплексных соединениях, в особенности с сильно разветвленными лигандами, эффект может не наблюдаться. Это связано, скорее всего, с наличием в кристаллической структуре большого числа «пустого пространства», что определяет «рыхлость» структуры. В этом случае связь металл — донорный атом упакована так, что не определяет собственно структуру. При этом большее влияние на строение кристаллов здесь оказывает лиганд.
Заметим, что все сказанное также прямо относится и к производным актинидов (с учетом их специфики). Главное, что межэлектронное электростатическое взаимодействие М—L для актинидов осложняется наличием ненулевого вклада ковалентных сил (в отличие от лантанидов, для которых вклад ковалентности в связь М—L существенно меньше).
Комплексы-переходных и непереходных металлов В начале главы перечислялись некоторые факторы, влияющие на устойчивость комплексных соединений, и делалась отсылка к материалу главы 3, где говорится о факторах, определяющих наличие того или иного КЧ. Еще раз подчеркнем, что на термодинамике системы в целом главным образом сказывается состав координационного полиэдра и его свойства. Следовательно, от того, насколько «комфортно» комплексообразователь располагается в ближнем окружении, зависит и «судьба» комплекса.
Этому заключению есть прямая аналогия. Так, из теории плотнейших упаковок следует, что серьезное отличие размера иона, находящегося в пустотах плотных упаковок, дестабилизирует всю структуру и определяет ее термодинамическую неустойчивость (к фазовому переходу). Точно так же и для комплексных соединений: существуют оптимальные соотношения размеров центральных атомов и лигандов, которые обеспечивают максимальную устойчивость комплекса при прочих равных условиях. Так, для этилендиаминтетраацетатов щелочноземельных металлов максимально стабилен комплекс кальция, а для тех же производных первого ряда переходных металлов — комплексы меди или железа.
В отличие от РЗЭ, другие комплексообразователи (в первую очередь ионы ^/-переходных и непереходных металлов, имеющие меньшие размеры) способны образовывать более ковалентные соединения, что не может не отразиться на свойствах рассматриваемых комплексов[11]. При их описании часто используют ТКИ—ТПЛ, а при трактовке стабильности применяют представление об ЭСКП (энергии экстрастабилизации), пытаются, ориентируясь на спектроскопические данные, связать энергетику координационных полиэдров с термодинамическими характеристиками вещества и, главное, часто пытаются перевести рассуждения об ионности—ковалентности на количественную основу. К сожалению, ионность—ковалентность — параметры не спектроскопические. Из этого же следуют и принципиальные затруднения при таких подходах.
Наиболее продуктивно составление рядов устойчивости для узких групп родственных соединений, особенно если учесть, что многие из рассматриваемых комплексообразователей способны создавать как в большой мере ионные, так и в существенной степени ковалентные комплексы (сравните, например, высокои низкоспиновые комплексы).
Правда, высокоспиновые комплексы характерны преимущественно для ионов металлов первого переходного ряда, тогда как для металлов второго, а тем более третьего переходного ряда доминируют именно низкоспиновые, т. е. по классификации Полинга — ковалентные комплексы. К примеру, для комплекса К21гС16 — соединения IrIV (5 = V2) с лигандом слабого поля, квантово-химическая оценка степени ионности связи Ir—С1 (расчет эффективного заряда, но Малликену) дает значение около 30%.
- [1] Трансурановые элементы в то время были неизвестны.
- [2] В. Клемм на этом основании построил даже периодическую систему редкоземельных элементов.
- [3] Fidelis /., Siekierski S. The regularities in stability constants of some rare earthcomplexes //J. Chromatog. 1965. V. 17. P. 542; J. Inorg. Nucl. Chcm. 1966. V. 28. P. 185.
- [4] Peppard D. F., Mason G. W., Lewey S. A tetrad effect in the liquid—liquidextraction ordering of lanthanides (III) //J. Inorg. Nucl. Chem. 1969. V. 31. P. 2271.
- [5] KatrielJ. y Paunez R. // Adv. Quantum Chem. 1977. V. 10. P. 143.
- [6] Jorgensen С. K., Reisfeld R. Structure & Bonding (1981); Nugent L.J. Theoryof the tetrad effect in the lanthanide (III) and actinide (III) series // J. Inorg. Nucl.Chem. 1970. V. 32, P. 3485; Mioduski T. The «regular» and «inverse» tetrad effect //Comments Inorg. Chem. 1997. V. 19 (2), P. 93.
- [7] Ионова Г. В. у Вохмин В. Г., Спицын В. Я. Закономерности изменения свойствлантанидов и актинидов. М.: Наука, 1990.
- [8] Ионова Г. В. у Вохмин В. Г., Спицын В. Я. Закономерности изменения свойствлантанидов и актинидов. М.: Наука, 1990.
- [9] Ионова Г. В. у Вохмин В. Г., Спицын В. Я. Закономерности изменения свойствлантанидов и актинидов. М.: Наука, 1990.
- [10] Киселев Ю. М. Закономерности в редкоземельном ряду // Жури, неорган.химии. 1994. Т. 39. С. 1266.
- [11] Ковалентность в определенной мере сказывается и на свойства описанныхвыше комплексов РЗЭ, так как изменение межэлектронного отталкивания и означает изменение степени ионности связи M—L.