Фосфор.
Неорганическая химия

Метафосфорные кислоты, метафосфаты. Молекулы кислот и анионы их солей имеют циклическое строение. В циклах каждый ортофосфатный тетраэдр связан двумя общими атомами кислорода с соседними тетраэдрами. Общая формула метафосфорных кислот (НРОз)", где п может принимать значения от 3 до 12. При более высоких значениях п не удается отличить циклические структуры от линейных. Простейшая из метафосфорных… Читать ещё >
Фосфор. Неорганическая химия (реферат, курсовая, диплом, контрольная)
Элементное состояние. Фосфор образует несколько аллотропных модификаций. Важнейшие среди них — белый, красный и черный. Белый и красный фосфор термодинамически неустойчивы, но могут существовать при нормальных условиях из-за малых скоростей превращения в устойчивую модификацию — черный фосфор.
Белый фосфор — белое мягкое воскообразное вещество или прозрачные кристаллы, состоящие из тетраэдрических молекул Р4 (рис. 19.13). Углы Р—Р—Р в таких тетраэдрах равны 60°, что гораздо меньше 90° между осями р-орбиталей.
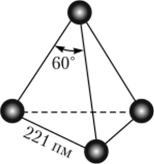
Рис. 19.13. Структура молекулы белого фосфора.
Эти углы, таким образом, очень напряжены, что придает белому фосфору большую химическую активность. Так как он легко окисляется и может самовоспламеняться на воздухе, его хранят под водой. Белый фосфор ядовит и очень огнеопасен.
Молекулярный характер кристаллов придает этой модификации легкоплавкость (?пл = 44°С), летучесть (?кип = 257°С) и растворимость в органических растворителях.
Красный фосфор существует в нескольких кристаллических формах, которые состоят из связанных между собой бесконечных цепей, образующихся при размыкании тетраэдров (рис. 19.14). Он обладает меньшей химической активностью, чем белый, не ядовит, загорается только при поджигании, нерастворим в органических растворителях.
Черный фосфор имеет графитоподобную слоистую структуру, в которой каждый атом Р связан с тремя другими (рис. 19.15). Слои связаны между собой слабо. Черный фосфор — наименее химически активная аллотропная модификация фосфора.
Получение. Белый фосфор получают при нагревании в электрической печи смеси фосфорита или апатита, кокса и кварцевого песка:
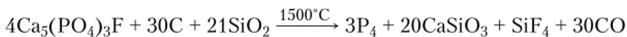
В результате длительного нагревания белого фосфора без доступа воздуха при атмосферном давлении образуется крас;
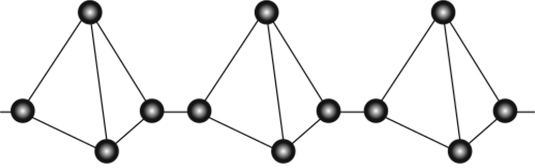
Рис. 19.14. Структура молекулы красного фосфора.
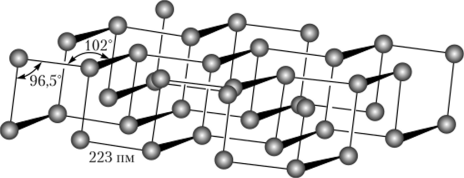
Рис. 19.15. Структура молекулы черного фосфора.
ный фосфор, а при высоком давлении — кристаллический черный фосфор.
Химические свойства. Белый и красный фосфор активно взаимодействуют с галогенами с образованием различных галогенидов фосфора. Белый фосфор светится в темноте вследствие протекающей даже при пониженных температурах реакции окисления его паров кислородом воздуха. Тонко измельченный белый фосфор самопроизвольно возгорается при комнатной температуре, компактный белый фосфор загорается прн нагревании до 50 °C. Температура воспламенения красного фосфора 210 °C, черный фосфор загорается примерно при 500 °C. При горении фосфора образуется оксид:
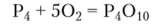
При сплавлении белого фосфора с серой и нагревании образовавшейся массы образуются сульфиды фосфора. Пары фосфора реагируют с азотом (в электрическом разряде), углеродом (2000°С) и кремнием (1000°С) с образованием соответственно нитридов и карбида фосфора и фосфида кремния. С бором и со всеми металлами фосфор при нагревании дает фосфиды. С водородом фосфор не взаимодействует.
При обычных условиях фосфор нс реагирует с водой и растворами неокисляющих кислот. Азотная кислота окисляет его до ортофосфорной кислоты. При нагревании фосфор вступает в реакцию с растворами щелочей, при этом выделяется фосфин. При взаимодействии белого фосфора с растворами солей электроположительных металлов образуются фосфиды этих металлов.
Бинарные соединения. В большинстве бинарных соединений (табл. 19.7) фосфор образует ковалентные связи с атомами других элементов. Частично ионные связи существуют только в некоторых солеобразных фосфидах.
Бинарные соединения фосфора и их значения AGf 298 (кДж/моль).
РН3(г). +13. | ||||||
Ы3Р (к). <0. | Ве3Р2(к). <0. | ВР (к). — 95. | Р2С6(ам). >0. | Р3Ы5(ам). — 1160. | Р4О10(к). — 2697. | PF3®. — 897. РР5(г). — 1517. |
Na3P (K). <0. | Mg3P2(K). <0. | А1Р (к). — 178,7. | SiP (K). — 71,7. | Ра.
| P4Sio (k). — 334. | РС13(ж). — 272. РС15(к). — 318. |
Солеобразные фосфиды. | Ковалентные фосфиды. | Молекулярные ковалентные соединения. | ||||
Фосфиды — соединения фосфора с менее электроотрицательными, чем фосфор, элементами. Щелочные, щелочноземельные металлы и магний образуют солеобразные фосфиды, которые содержат фосфид-ион Р3. Эти соединения легко гидролизуются водой и разлагаются кислотами с выделением фосфина. Некоторые металлы образуют несколько типов фосфидов с разнообразными формулами и типами структур. Анионы в таких фосфидах состоят из атомов фосфора, соединенных связями Р—Р в цепи, кольца и слои.
Элементы 13-й и 14-й групп, а также бериллий образуют ковалентные фосфиды. Это тугоплавкие соединения, устойчивость которых к химическим воздействиям зачастую определяется наличием или отсутствием примесей. Химически чистые ковалентные фосфиды могут быть достаточно устойчивыми веществами. Свойства этих соединений рассмотрены в предыдущих главах.
С элементами 15-й, 16-й и 17-й групп фосфор образует ковалентные молекулярные соединения, отличающиеся большим разнообразием свойств. Нитриды фосфора рассмотрены в параграфе 19.2.
Соединения с водородом. Фосфор образует с водородом несколько соединений. Важнейшими из них являются монофосфин РН3 и дифосфин Р2Н4. Монофосфин — бесцветный газ с запахом гнилой рыбы, ?кип = -87,4°С. Дифосфин — бесцветная летучая жидкость, ?пл = -99,0°С, ?кип = 65,2°С. Молекула РН3 имеет форму тригопальной пирамиды, подобно молекуле аммиака, но отличается от нее гораздо меньшим ва;
лентным углом (ZHPH = 94°, ZHNH = 107°), что свидетельствует о практически полном отсутствии гибридизации орбиталей (см. рис. 11.8). Дифосфин, но строению молекулы подобен гидразину (см. рис. 19.4). Практическое равенство электроотрицательностей фосфора (2,19) и водорода (2,2) придает связям Р—Н ковалентный характер. Водородные связи между молекулами РН:) не образуются, поэтому фосфин имеет более низкие температуры плавления и кипения, чем аммиак (см. рис. 14.2).
Простейший способ получения монофосфина — гидролиз солеобразных фосфидов металлов или их взаимодействие с кислотами:
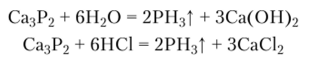
Монофосфин можно получить также при нагревании белого фосфора с концентрированным раствором сильного основания:
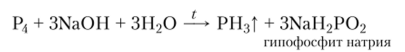
Во всех этих реакциях в качестве побочного продукта в небольших количествах образуется также и дифосфин.
Монофосфин и дифосфин термодинамически неустойчивы. При нагревании без доступа воздуха они разлагаются. В продуктах разложения дифосфина наряду с фосфором и монофосфином содержатся твердые аморфные соединения фосфора с водородом, имеющие составы: Р2Н, Р5Н2, P2 и др.
Электрический дипольный момент молекулы PI 1:! очень мал, поэтому монофосфин растворяется в воде намного хуже, чем аммиак. В отличие от аммиака монофосфин взаимодействует с водой очень слабо. В его водном растворе устанавливаются равновесия:
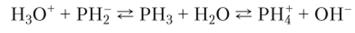
Однако константы равновесия для обоих процессов очень малы и почти равны между собой, поэтому водные растворы монофосфина не проявляют ни кислотном), ни основного характера. Дифосфин не растворяется в воде и не взаимодействует с ней.
Катион фосфония РН4 малоустойчив. Он образуется, например, при смешении газообразных РН3 и HI: 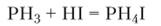
Образующаяся в результате этой реакции соль — иодид фосфония — существует при низких температурах в виде бесцветных кристаллов. Соли фосфония разлагаются водой и растворами сильных оснований с выделением РН3:
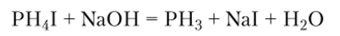
Монофосфин, соли фосфония и дифосфин — сильные восстановители. Дифосфин самовоспламеняется на воздухе и горит с образованием оксида фосфора (У):
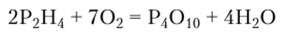
То же самое происходит с монофосфином, если он содержит примеси Р2Н4.
Очищенный РН3 загорается па воздухе при нагревании до температур выше 100 °C, при его горении также образуется оксид фосфора (У):
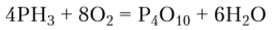
Галогениды. В отличие от азота фосфор образует два ряда галогенидов: РГ3 и РГ5 (Г = F, Cl, Br, I), в которых фосфор имеет степени окисления +3 и +5.
Тригалогениды РГ3 имеют строение тригональных пирамид с валентными углами ГРГ около 100°. При обычных условиях PF3 — бесцветный газ, РС13 и РВг3 — бесцветные жидкости, Р13 — красное кристаллическое вещество. Их получают синтезом из простых веществ:
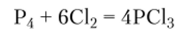
Гидролиз тригалогенидов приводит к образованию фосфористой кислоты:
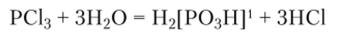
Окисление кислородом превращает тригалогениды в тригалогенид-оксиды (оксотригалогениды), молекулы которых имеют структуру искаженного тетраэдра:
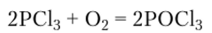
Аналогичное строение имеет трихлорид-сульфид (тиохлорид) фосфора PSC13.
Трихлорид РС13 и трихлорид-сульфид PSC13 фосфора используют для получения многих пестицидов.
Пентагалогениды РГ5 со степенью окисления фосфора +5 образуются фтором, хлором и бромом: PF5, PCI5 и РВг5. При[1]
обычных условиях PF5 — бесцветный газ. PCI5 и РВг5 — кристаллические вещества. Кристаллы PCI5 состоят из тетраэдрических катионов РС14 и октаэдрических анионов PClg. Молекулы этих соединений в жидком и газообразном состоянии имеют геометрию тригональной бипирамиды с spd-гибридизацией валентных орбиталей атома фосфора. Структура РГ5 изображена на рис. 11.27.
Получают пентагалогениды из тригалогенидов:
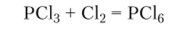
При взаимодействии с водой пентагалогениды фосфора подвергаются гидролизу: в холодной воде из пентахлорида получается трихлорид-оксид фосфора:
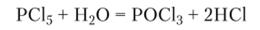
в кипящей воде образуется ортофосфорная кислота:
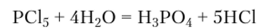
При гидролизе POCI3 также образуется ортофосфорная кислота.
При взаимодействии пентафторида фосфора с фторидами металлов во фтороводородной кислоте образуются комплексные соединения — гексафторофосфаты, например гексафторофосфат (У) натрия:
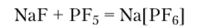
Гексафторофосфаты (У) лития, натрия и аммония хорошо растворимы в воде. В растворах этих солей присутствует гексафторофосфаг (У)-ион [PFC], который вследствие sp3d2-гибридизации электронных орбиталей атома фосора имеет форму правильного октаэдра. Гексафторофосфаты — соли гексафторофосфорной кислоты H[PFe].
Известны также монофторофосфорпая H2[P03F] и дифторофосфорная H[P02F2| кислоты и их соли.
Галогениды фосфора токсичны.
Оксиды. Известно несколько оксидов фосфора, важнейшие из них — гексаоксид тетрафосфора P^Og и декаоксид тетрафосфора Р4О10.
Гексаоксид тетрафосфора [оксид фосфора (Ш)] Р406 — летучее бесцветное вещество (?пл = 24 °C, tKm =175°С). Структура молекулы Р4Ое показана на рис. 19.16. Этот оксид образуется с 50%-пым выходом при горении фосфора при ограниченном доступе сухого воздуха: 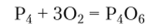
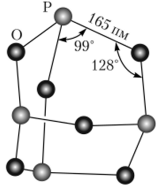
Рис. 19.16. Строение молекулы Р4Ое.
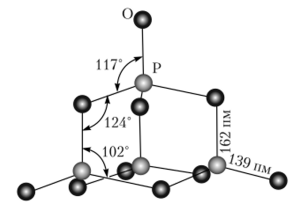
Рис. 19.17. Строение молекулы Р4О10.
Гексаоксид тетрафосфора — кислотный оксид. При растворении его в холодной воде образуется фосфористая кислота:
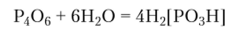
В горячей воде он диспропордионирует с образованием ортофосфорной кислоты и фосфина:
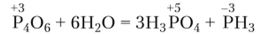
При нагревании на воздухе ()в окисляется до Р4О10
![Декаоксид тетрафосфора (оксид фосфора(У)] Р4Ою образует несколько кристаллических и аморфную стекловидную модификацию. Структура молекулы Р4Ою показана на рис. 19.17. Эта молекула и кристаллические модификации оксида фосфора(У) состоят из тетраэдров Р04, соединенных вершинами. Получают Р4О10 сжиганием белого фосфора в избытке кислорода.](/img/s/8/80/1513380_25.png)
Декаоксид тетрафосфора (оксид фосфора (У)] Р4Ою образует несколько кристаллических и аморфную стекловидную модификацию. Структура молекулы Р4Ою показана на рис. 19.17. Эта молекула и кристаллические модификации оксида фосфора (У) состоят из тетраэдров Р04, соединенных вершинами. Получают Р4О10 сжиганием белого фосфора в избытке кислорода.
Гексаоксид тетрафосфора очень гигроскопичен. Он жадно поглощает воду и используется как эффективный осушитель и сильный дегидратирующий агент.
Декаоксид тетрафосфора — кислотный оксид. Он реагирует с водой с образованием смеси фосфорных кислот. С основными оксидами образует фосфаты.
Оксиды фосфора токсичны.
Сульфиды. При взаимодействии фосфора и серы образуется ряд сульфидов. Все они представляют собой желтые кристаллические вещества. Важнейшие из них — трисульфид тетрафосфора P4S;j и декасульфид тетрафосфора P4S10. Структура молекулы P4S3 показана на рис. 19.18. Это вература воспламенения 80—89°С). P4S10 имеет ту же структуру, что и Р^ОюЕго используют в производстве инсектицидов и антикоррозионных добавок к смазочным маслам.
щество — компонент зажигательной смеси для спичечных коробков (темпе.
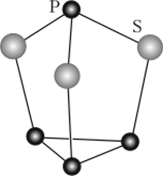
Рис. 19.18. Строение молекулы P/4S3.
Кислородсодержащие кислоты фосфора и их соли.
В степенях окисления от +1 до +5 фосфор образует большое количество разнообразных по строению и химическим свойствам кислородсодержащих кислот. К отщеплению катиона водорода в их молекулах способны только группы —РОН. Атомы водорода, непосредственно связанные с атомом фосфора, не способны к электролитической диссоциации. Молекулы и анионы кислородсодержащих кислот либо имеют форму правильного или искаженного тетраэдра, либо состоят из структурных единиц, представляющих собой тетраэдры вследствие 5/?3-гибридизации электронных орбиталей атома фосфора. Ниже будут рассмотрены только важнейшие из кислородсодержащих кислот фосфора.
Фосфорноватистая кислота, гипофосфиты. Фосфорноватистая кислота Н[Р02Н2] — твердое белое вещество (?пл = = 26,5°С), хорошо растворимое в воде. При нагревании до температуры выше 50 °C разлагается с выделением фосфина, красного фосфора, ортофосфорной кислоты и водорода.
Фосфорноватистая кислота — слабая одноосновная кислота, К = 8,9 * 10~2. При взаимодействии с основаниями образует соли — гипофосфиты, например гииофосфит мафия NaH2P02. Гипофосфит-ион имеет форму искаженного тетраэдра:
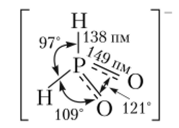
Фосфорноватистая кислота и ее соли — сильные восстановителиу так как содержат фосфор в низкой степени окисления + 1.
Гипофосфиты получают кипячением белого фосфора в растворах сильных оснований, их используют в качестве восстановителей при нанесении покрытий из никеля, кобальта и олова на металлы и пластмассы. Фосфорноватистую кислоту получают действием серной кислоты на гипофосфиты, ее используют в производстве полимерных материалов.
Фосфористая кислота, фосфиты. Фосфористая кислота Н2[Р03Н] — расплывающееся бесцветное твердое вещество (?пл = 73,6°С), очень хорошо растворимое в воде.
Фосфористая кислота — слабая двухосновная кислота. К = 5,1 10 2, К2 = 1,8−10 1. При взаимодействии с основаниями она образует два ряда солей — фосфиты, например фосфит натрия Na2HP03, и гидрофосфиты, например гидрофосфит натрия NaH2P03.
Молекула Н2[Р03Н], гидрофосфити фосфит-ион имеют структуры искаженных тетраэдров:
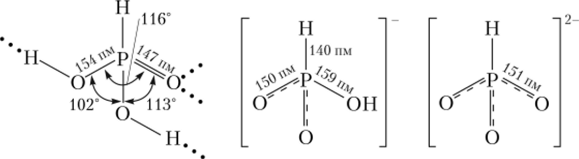
Атом водорода, непосредственно связанный с атомом фосфора, не может отщепляться при электролитической диссоциации и участвовать в образовании водородной связи, обозначенной в графической формуле тремя точками.
Фосфористая кислота и ее соли — восстановители. Фосфористую кислоту получают гидролизом трихлорида фосфора РС13, растворением P40(j в воде или действием серной кислоты на фосфиты.
Ортофосфорпая кислота, ортофосфаты. Ортофосфорная (фосфорная) кислота Н3Р04 — бесцветное кристаллическое гигроскопичное вещество (?пл = 42,5°С), расплывающееся на воздухе. Н3Р04 — самая устойчивая из кислородсодержащих кислот фосфора. Она настолько хорошо растворима в воде, что смешивается с ней практически в любых соотношениях. Концентрированные растворы Н3Р04 обладают очень высокой вязкостью, они сиропообразны.
Молекулы ортофосфорной кислоты имеют форму искаженного тетраэдра:
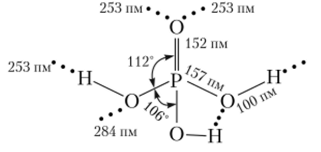
Кристаллы безводной Н3Р04 имеют слоистую структуру. Каждая молекула внутри слоя соединена с шестью другими водородными связями двух типов и различной длины: короткими связями Р=0-«Н—О (253 им) и длинными связями между двумя группами —ОН (284 им). В водных растворах наряду с этими связями образуются более прочные водородные связи Н3РО4 с молекулами воды.
В промышленности ортофосфорную кислоту получают экстракционным и термическим способами.
Экстракционный способ заключается в разложении природных фосфатов серной кислотой:
Ca5(P04)3F + 5H2S04 = ЗН3РС)4 + 5CaS04 + HF.
Массовая доля Р4Ою в экстракционной ортофосфорной кислоте составляет 40%. Она содержит много примесей. Ее используют главным образом для производства фосфорных удобрений.
Термический способ основан на взаимодействии с водой Р4Ою, полученного при сжигании белого фосфора:
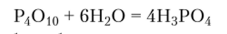
Этот способ требует больших затрат энергии, но позволяет получать более чистую ортофосфорную кислоту. Массовая доля Р4Ою в термической ортофосфорной кислоте составляет 85%.
Ортофосфориая кислота — слабая трехосновная кислота. К = 7,1 • 10-3, К2 = 6,2 • 10 8, К3 = 5,0 • 10^3. Она реагирует с гидроксидами, карбонатами и некоторыми металлами с образованием дигидроортофосфатов, гидроортофосфатов и ортофосфатов: 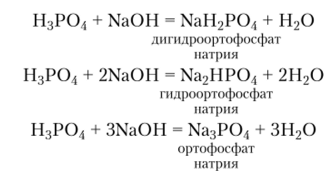
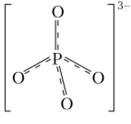
Ортофосфат-ион — правильный тетраэдр:
Из средних ортофосфатов в воде хорошо растворимы соли щелочных металлов и аммония. Средние ортофосфаты, содержащие многозарядные катионы металлов, в воде не растворяются. Растворимость гидрои ди гидроортофосфато в выше, чем у средних солей. Многие соли ортофосфорной кислоты выделяются из водных растворов в виде разнообразных кристаллогидратов, которые при нагревании теряют кристаллизационную воду ступенчато без изменения состава аниона. Практически все безводные ортофосфаты (за исключением солей аммония и ртути) устойчивы при нагревании вплоть до температур плавления. Анионы кислых солей при нагревании ниже температур плавления превращаются в анионы конденсированных фосфорных кислот.
Наибольшее практическое значение имеют соли, которые ортофосфорная кислота образует с аммонием, калием и кальцием. Гидроортофосфат (NH4)2HP04 и дигидроортофосфат NH4H2P04 аммония, ортофосфат Саз (Р04)2, гидроортофосфат Са11Р04 и дигидроортофосфат Са (Н2Р04)2 кальция находят применение в качестве удобрений. Дигидроортофосфат калия КН2Р04 входит в состав удобрений, пекарских порошков, жидких моющих средств, гидроортофосфат калия К2НР04 используют как питательную среду для выращивания плесневых грибов, продуцирующих пенициллины. Обе кислые соли калия входят в состав пищевых дрожжей.
Поскольку фосфорная кислота слабая, ее соли в водных растворах подвергаются гидролизу по аниону:
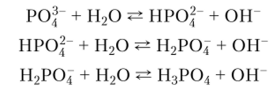
Растворы, содержащие одновременно дигидрофосфаты и гидрофосфаты щелочных металлов, обладают буферными свойствами. Их называют фосфатными буферными растворами и используют для поддержания постоянных значений pH в диапазоне от 5,4 до 8,0. Фосфатные буферные растворы существуют и в природе. Внутри клеток действует фосфатная буферная система, состоящая из КН2Р04 и К2НР04, в межклеточной жидкости — из NaH2P04 и Na2HP04.
Конденсированные фосфорные кислоты и их соли. Массовая доля Р4О]0 в 100%-ной ортофосфорной кислоте составляет 72,4%. Более высокое содержание Р4Ою имеет фосфолеум, или суперфосфорная кислота, — равновесная система, в со;
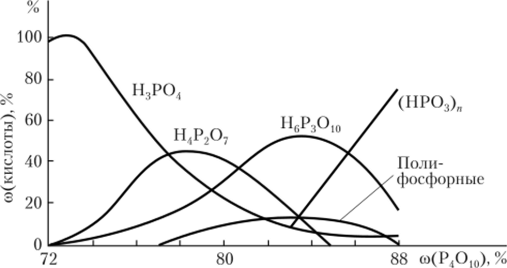
Рис. 19.19. Состав фосфолеума в зависимости от массовой доли Р4О10.
став которой наряду с ортофосфорной входят конденсированные фосфорные кислоты (рис. 19.19).
Конденсированными фосфорными кислотами называют кислоты, содержащие в молекуле более одного атома фосфора и имеющие связи Р—О—Р.
Они образуются при обезвоживании ортофосфорной кислоты. Все конденсированные фосфорные кислоты содержат в качестве структурной единицы ортофосфатный тетраэдр РО4, который может иметь один, два или три общих атома кислорода с соседними тетраэдрами. Соединяясь, тетраэдры образуют цепи, циклы и разветвленные структуры. По структуре молекул конденсированные фосфорные кислоты делят па полифосфориые (с цепной структурой), метафосфорные (циклические) и ультрафосфорные (с разветвленной структурой). Тетраэдры Р04, находящиеся на концах цепи (концевые тетраэдры), связаны с соседним тетраэдром одним общим атомом кислорода. Тетраэдры Р04, находящиеся в середине цепи или в цикле (срединные тетраэдры), связаны со своими соседями двумя атомами кислорода. Тетраэдры, находящиеся в точках разветвления цепи, имеют три связывающих атома кислорода:
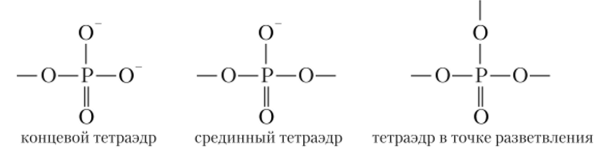
Все конденсированные кислоты являются многоосновными. Они образуют средние и кислые соли.
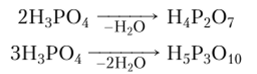
Полифосфорные кислоты, полифосфаты. Эти вещества образуют цепочечные структуры. В цепь может быть связано различное число ортофосфатных тетраэдров, начиная с двух. Простейшая полифосфорная кислота — это четырехосновная пирофосфорная (дифосфорная) кислота Н4Р207:
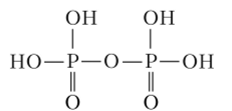
Она значительно отличается от других полифосфорных кислот по строению молекулы, которая состоит из двух концевых тетраэдров Р04, соединенных общим атомом кислорода. Молекулы других полифосфорных кислот содержат срединные тетраэдры. Угол POP в зависимости от размеров катиона металла меняется от 123 до 180°. Соли этой кислоты — пирофосфаты (дифосфаты). Их получают термической дегидратацией гидроортофосфатов:
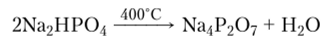
Следующая по длине цепи — пятиосновная трифосфорная кислота 115Р3010:
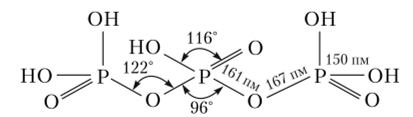
Ее соль, трифосфат натрия, можно получить по реакции.
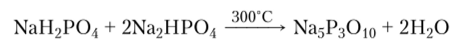
Полифосфорные кислоты образуются при дегидратации ортофосфор ной ки сл о гы:
При увеличении числа срединных тетраэдров образуются полифосфорные кислоты, цепи которых содержат десятки, сотни и даже тысячи атомов фосфора. Полифосфорные кислоты неустойчивы, при добавлении к фосфолеуму воды они быстро разлагаются с образованием ортофосфорной кислоты и выделением большого количества теплоты.
Большинство полифосфатов нерастворимо в воде. Растворяются только полифосфаты щелочных металлов. В водных растворах эти соли неустойчивы и разлагаются с образованием ортофосфатов. Однако высокие энергетические барьеры (энергии активации) этих реакций сильно их замедляют. Для достижения равновесия при обычных условиях требуются многие часы, сутки, иногда годы. Скорость реакции существенно возрастает при нагревании и в присутствии ферментов.
Из всех полифосфатов в наибольших количествах производится трифосфат натрия Ыа5РзО|0. В виде безводной соли он входит в состав моющих средств, используется в производстве цемента, при бурении нефтяных скважин и в текстильной промышленности. Кристаллогидрат Na^P jOio-GIbO находит применение в пищевой промышленности: его добавляют в сыры, колбасы и сгущенное молоко для повышения их однородности и улучшения консистенции. Полифосфаты натрия используют также для умягчения воды, потому что они образуют комплексные соединения с катионами магния и кальция.
Метафосфорные кислоты, метафосфаты. Молекулы кислот и анионы их солей имеют циклическое строение. В циклах каждый ортофосфатный тетраэдр связан двумя общими атомами кислорода с соседними тетраэдрами. Общая формула метафосфорных кислот (НРОз)", где п может принимать значения от 3 до 12. При более высоких значениях п не удается отличить циклические структуры от линейных. Простейшая из метафосфорных кислот — трехосновная триметафосфорная (трициклофосфорная) кислота Н3Р3О9 или (НР03)з может быть получена при замыкании в цикл цепи трифосфорной кислоты:
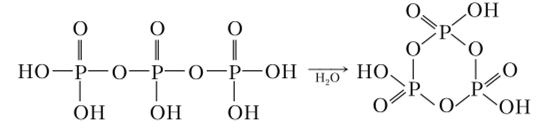
Соли этой кислоты — триметафосфаты (трициклофосфаты), например тримстафосфат натрия Ыа3РзОд. Известны также тетра-, пента-, гекса-, гептаи октаметафосфаты. Некоторые из них образуют кристаллогидраты, например NajPjOg-GlCO. При нагревании кристаллогидраты теряют кристаллизационную воду без разрыва циклов. В воде хорошо растворимы только метафосфаты щелочных металлов и аммония. Соли, содержащие многозарядные катионы, растворяются плохо.
В разбавленных водных растворах мстафосфорныс кислоты медленно разрушаются. Этот процесс начинается с размыкания цикла и заканчивается образованием ортофосфорной кислоты. Метафосфаты устойчивы в нейтральных водных растворах при комнатной температуре, но разлагаются в щелочных растворах. Процесс, как и в случае метафосфорных кислот, начинается с размыкания цикла.
Улътрафосфорные кислоты, ультрафосфаты. Молекулы ультрафосфорных кислот и анионы их солей — ультрафосфатов — имеют разветвленное строение. Они могут содержать и линейные, и циклические фрагменты. Простейшая из ультрафосфорных кислот имеет следующее строение:
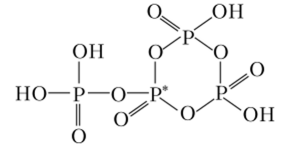
Получить ее можно при взаимодействии Р4Ою с парами воды.
В молекулах ультрафосфорных кислот и анионах их солей всегда присутствуют тетраэдры Р04, связанные тремя общими атомами кислорода с соседними тетраэдрами. (В графической формуле центральный атом Р такого тетраэдра отмечен звездочкой.) Наличие таких групп является причиной малой устойчивости этих веществ. При соприкосновении с водой ультрафосфорные кислоты разлагаются по точкам разветвления на полифосфорные и метафосфорные кислоты, а ультрафосфаты — на полии метафосфаты.
- [1] Вне квадратных скобок находятся катионы водорода, отщепляемыепри диссоциации в водных растворах, а внутри квадратных скобок — анион.