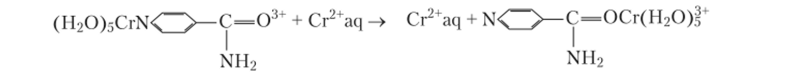Описан двухстадийный процесс переноса электрона, в котором в промежуточном состоянии (па первой ступени) электрон «располагается» преимущественно на мостике. Этот вариант механизма предполагается для мосгикового лиганда, способного к восстановлению, при условии, что окислитель соответственно не препятствует указанному «размещению», т. е. соблюдается некий баланс сил. Тоуб полагает, что изоникотинамид в качестве мостикового лиганда для данного механизма является весьма показательным примером и иллюстрирует эту мысль следующей реакцией:
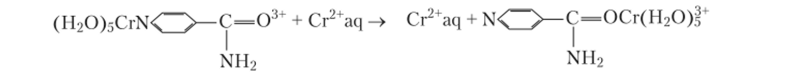
k = 1,8 (л/моль • с) при 25 °C (в ней скорость реакции не зависит от изменения свободной энергии).
Таблица 133
Константы скоростей реакции образования некоторых комплексов (25°С).
Окислитель. | Восстановитель. | Мостик, X. | k2, л/моль-с. |
Co (NH3)sX2+ | Сг (ОН2)Г. | CH3COO. | 1,8- 10 1 |
Co (NH3)5X',+ | Сг (()Н2)Г. | NCS. | 1,9? 10. |
Co (NH3)5X" + | Cr (OH2)|+ | CN. | 3,6 10. |
Co (NH3)5X" + | Cr (OH2)g+ | N3 | 3- 105 |
Co (NH3)5X',+ | Сг (ОН2)Г. | Br. | 1,4 • 10G |
Co (NH3)5X',+ | Сг (ОН2)|+ | I. | 3,4? 106 |
Co (NH3)5X" + | Cr (()H2)i+ | P04 | О. oo. |
Co (NH3)5F2+ | Сг (ОН2)Г. | F. | 2,5 • 105 |
Co (NH3)3Cl2+ | Cr (OH2)g+ | Cl. | О О. ID |
Co (NH3)5(OH2)3+ | Сг (ОН2)Г. | H2(). | 1 • 10 1 |
Co (NH3)5X" + | Со (СЫ)Г. | po4 | 5,2 • 102 |
Co (NH3)5X''+ | Со (СХ)Г. | NCS. | 1,1 • 106 |
Co (NH3)5X" + | Co (CN)f; | N3 | 1,6- 10K |
Co (NH3)5X"+ | Co (CN)f. | Cl. | 5 • 107 |
Со (ЫН3)5Хл+ | Co (CN)f. | Br. | 2 • 109 |
Co (NH3)5X" + | Fc (OH2)2+ | Br. | 7,3 • lO-4 |
Co (NH3)3X''+ | Fe (OH2)l+ | Cl. | 1,4 • 10 3 |
Co (NH3)5X" + | Fe (OH2)§+ | NCS. | 3- 10 3 |
Co (NH3)5X"+ | Fe (OH2)g+ | F. | 6,6 • lO'3 |
Co (NII3)5X',+ | Fe (OH2)|+ | N3 | OO. Vi. |
Cr (OH2)5F2+ | Сг (ОН2)Г. | F. | 7,4? 10-3 |
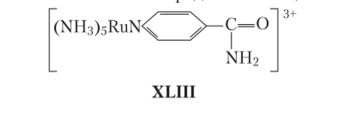
Необходимость соблюдения указанного выше баланса сил можно заключить сопоставлением предыдущего процесса с, вроде бы, аналогичной реакцией с применением другого окислителя, близкого по геометрии и почти с таким же пелокс-потенциалом:
На удивление, скорость реакции соединения рутения с Сга2+ оказывается существенно выше. Возрастание скорости для рутениевого мостика объясняют следующим образом. В ионах Сг (Ш) (7/5, ?fg) дополнительный электрон может разместиться на-орбиталях, которые имеют a-симметрию и практически не взаимодействуют с л-системой донорного лиганда, являющегося источником этого электрона. Для рутения ситуация иная, так как в ионах Ru (III) (15, t%g) электрон должен попасть на t2g- орбитали л-симметрии, которая может взаимодействовать с л-системой мостикового лиганда напрямую.