Химические свойства.
Общая и неорганическая химия

Таким образом, тот факт, что азот при всех температурах во всех агрегатных состояниях находится в форме молекул Na, а фосфор при стандартных условиях — в виде более сложных молекул, нельзя объяснить неустойчивостью молекул Ра. Тройная связь в молекулах Na и Ра очень прочна, но при понижении температуры, когда энтропийный фактор оказывает все меньшее влияние на состояние системы, становится… Читать ещё >
Химические свойства. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Строение электронных оболочек атомов элементов V группы повторяет то, что мы уже обсуждали в группах галогенов и халькогенов. Азот не имеет р-электронов в остове и вакантных d-орбиталей. Они появляются только у фосфора. У мышьяка, как у брома и селена, появляются остовные </-электроны, что отражается на экранировании валентных электронов и затрудняет достижение высшей степени окисления. Наконец, в случае висмута s-электроны лишь с большим трудом участвуют в образовании связи, поэтому степень окисления +5 становится труднодостижимой.
Азот. Этот элемент образует единственное простое вещество — молекулярный азот, состоящий из двухатомных молекул. Азот — бесцветный газ без запаха и вкуса с низкими температурами плавления и кипения. В молекуле N2 реализуются условия для образования трех связей — одной Ор.р- и двух ‘Пр.р-связей. Это делает молекулу N2 самой прочной из всех двухатомных гомонуклеарных молекул. Степень диссоциации молекул N2 составляет:
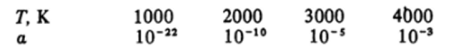
Большая прочность связи в молекуле предопределяет и химические свойства азота. Во-первых, большинство реакций с участием молекулярного азота эндотермичны, и, во-вторых, энергии их активации очень велики.
При обычных условиях азот реагирует лишь с одним элементом — литием:
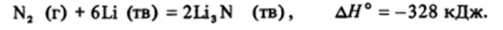
Образующийся нитрид лития — одно из немногих соединений, в составе которых обнаруживается ион N*" .
При воздействии электрического разряда, УФ-облучения, высокочастотных полей азот активируется и тогда легко реагирует со многими неорганическими и органическими веществами.
Чрезвычайно важна способность некоторых бактерий осуществлять восстановление азота до аммиака при обычных условиях.
Повышение температуры до 500−1 000 °С приводит к увеличению реакционной способности азота, и в этих условиях он реагирует со многими металлами: 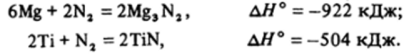
Большинство нитридов, особенно нитриды с/-элементов — это твердые вещества, которые имеют широкие области гомогенности. Их состав часто не соответствует обычным степеням окисления, температуры плавления таких нитридов обычно очень высоки.
С водородом и кислородом азот при обычных условиях не реагирует.
Основная масса получаемого азота идет на синтез аммиака и азотной кислоты. Кроме того, он используется для создания инертной атмосферы в некоторых производствах.
Фосфор. При переходе от азота к фосфору, так же как и при переходе от кислорода к сере, прочность itpp -связей уменьшается в большей мере, чем a-связей, поэтому при обычных условиях в твердом состоянии минимуму энергии отвечает образование трех a-связей, а не кратная связь между двумя атомами, как в случае азота. Три a-связи позволяют получить бесконечные плоскости, и такая конфигурация реализуется в черном фосфоре. Но, кроме того, как и в случае серы, возможно образование небольших замкнутых молекул. Ниже 1 200 °С наиболее устойчивы молекулы Р4, в которых атомы фосфора расположены в вершинах тетраэдра и каждый атом образует три a-связи (рис. 23.1). При охлаждении паров фосфора ниже 287 °C они конденсируются в бесцветную или бледно-желтую жидкость, которая при 44 °C застывает, образуя мягкую массу, похожую на воск, — белый фосфор. Это твердое вещество, построенное из молекул Р4. Как видно из рис. 23.1, углы между связями в молекуле равны 60е, что существенно меньше, чем нормальный угол между рорбиталями, равный 90°. Поэтому молекула Р4 излишне напряжена и, как следствие этого, очень реакционноспособна. Белый фосфор загорается на воздухе уже при 50 °C, поэтому хранят его под водой в темноте.
На свету или при нагревании без доступа воздуха белый фосфор переходит в более стабильную полимерную модификацию, имеющую слоистую структуру с менее напряженными связями. Полимерные модификации в зависимости от условий имеют разную окраску и несколько различающиеся свойства.
Наиболее часто приходится иметь дело с красным фосфором. Он гораздо менее активен, чем белый, не растворяется в CS^, плавится под давлением при «580 °С и загорается только при нагревании до «5 250 °С. В отличие от белого, красный фосфор не ядовит.
Самой устойчивой модификацией при стандартных условиях является черный фосфор, который может быть получен в результате длительного нагревания белого при температуре 200 °C и давлении 12 • 105 кПа. В черном фосфоре атомы связаны друг с другом таким образом, что образуется два слоя с пирамидальным расположением связей, причем углы между ними равны 99° (рис. 23.2). Черный фосфор еще менее активен, чем красный.
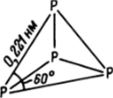
Рис. 23.1. Строение тетраэдрической молекулы Р4.
Грань тетраэдра — равносторонний треугольник, поэтому угол между связями равен 60°.
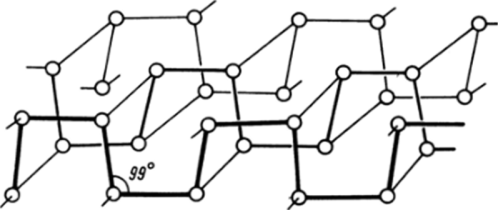
Рис. 23.2. Фрагмент двойной бесконечной плоскости атомов в черном фосфоре.
Угол между связями в этом случае равен 99°, что гораздо ближе к нормальному углу (90°) между чистыми-орбиталями При нагревании всех модификаций фосфора образуется пар, состоящий из молекул Р4, конденсация которого дает белый фосфор. Четырехатомные молекулы устойчивы до «1200 °С, а при дальнейшем нагревании диссоциируют на двухатомные:

Следует подчеркнуть, что молекула Р2, как и N2, исключительно устойчива — ее распад на атомы начинается выше 3 000 °С.
Для сравнения приведем энергии разрыва связи некоторых двухатомных молекул и температуры, при которых константы их диссоциации равны 1:
С1-С1. | s=s. | Р=Р. | О. II. О. | Z. III. Z. | |
Д/У, кДж/моль. | |||||
Г. °с. | 1 811. | 3 220. | 3 847. | 3 535. | 6 744. |
Как видно, молекула Ра по прочности связи почти нс уступает О, и заметно превосходит S,. Однако изменение энтропии при диссоциации тяжелых молекул Р, меньше, чем легких молекул Оа, и поэтому термическая устойчивость Ра оказыва ется даже больше, чем Оа.
Таким образом, тот факт, что азот при всех температурах во всех агрегатных состояниях находится в форме молекул Na, а фосфор при стандартных условиях — в виде более сложных молекул, нельзя объяснить неустойчивостью молекул Ра. Тройная связь в молекулах Na и Ра очень прочна, но при понижении температуры, когда энтропийный фактор оказывает все меньшее влияние на состояние системы, становится возможной полимеризация молекул Эа либо с образованием более сложных газообразных молекул, либо с образованием каких-то кристаллических полимерных структур. В этом случае вместо пр.р-связей должны образоваться а- связи. В случае азота энергия я-связи больше, чем о-свяэи, и я-свяэи в молекуле Na сохраняются. В случае фосфора (а также мышьяка и сурьмы) энергия о-связи больше* чем я-связи, и последние разрушаются, переходя в о-связи в полимерных структурах.
При обычных условиях фосфор, как белый так и красный, энергично реагирует с галогенами. Вспомните получение иодоводорода (см. разд. 21.3). Белый фосфор окисляется при комнатной температуре кислородом воздуха, причем этот экзотермический процесс сопровождается хемилюминесценцией — выделением энергии в виде света. Поэтому белый фосфор при соприкосновении с воздухом светится в темноте, что и послужило основанием для названия элемента — «светоносный». Окисление происходит по цепному механизму, и его скорость максимальна при некотором оптимальном парциальном давлении кислорода. В чистом кислороде окисление идет медленно и фосфор не светится.
При нагревании фосфор реагирует со многими металлами, выступая в роли окислителя и образуя фосфиды:

С неметаллами он реагирует как восстановитель:
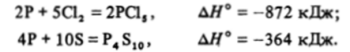
Основная масса получаемого в промышленности фосфора перерабатывается в фосфорную кислоту и фосфорные удобрения. Значительная часть его используется в спичечном производстве, а также в металлургии.
Мышьяк. При переходе от фосфора к мышьяку еще больше уменьшается энергия л'-свяэей по сравнению с о-связями, а значит, усиливается тенденция к образованию полимерных структур. Кроме того, увеличение главного квантового числа внешних электронов приводит к сближению энергетических зон в твердом теле и нарастанию металлических свойств.
Мышьяк в твердом состоянии имеет две модификации — желтую, образованную молекулами AS4, и серую. Строение серого мышьяка аналогично строению черного фосфора, но уменьшение ширины запрещенной зоны в случае мышьяка приводит к появлению свободных электронов и, как следствие, заметной электропроводимости и металлического блеска у серого (или металлического) мышьяка. Переход из желтой формы, которая получается при быстрой конденсации паров, в серую происходит гораздо легче, чем у фосфора.
Желтая форма, подобно белому фосфору, растворима в CS, и некоторых органических растворителях. Металлический мышьяк не растворяется без химического взаимодействия.
В парах ниже 800 °C мышьяк существует в виде молекул As4, а при более высокой температуре в виде AS2, имеющих такое же строение, как Р4 и Р2.
При стандартных условиях мышьяк реагирует только с галогенами, но не окисляется кислородом. При нагревании на воздухе он сгорает, образуя оксид мышьяка (III).
С тяжелыми металлами — свинцом, серебром, золотом — мышьяк образует сплавы, со щелочными и щелочноземельными — стехиометрические соединения арсениды, с большинством переходных металлов — нестехиометрические кристаллические фазы:
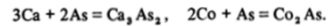
Основное применение мышьяка — получение ряда сплавов. В частности, его добавляют к свинцу при производстве ружейной дроби. Соещшения мышьяка используются в медицине, сельском хозяйстве, в промышленности полупроводников.
Сурьма. В русской химической литературе употребляются наименования соединений этого элемента, производные от трех его названий — персидского «сурьма**, латинского «стибиум** и арабского «антимоний». Например, соединение сурьмы с водородом SbH3 называется стибин, а соли сурьмяной кислоты — антимонаты.
При переходе от мышьяка к сурьме продолжается нарастание металлических свойств. По внешнему виду сурьма — металл, обладающий, однако, значительной хрупкостью. Сурьма легко измельчается при растирании в ступке. Желтая форма сурьмы, состоящая из молекул Sb4, крайне неустойчива.
При стандартных условиях сурьма, подобно фосфору и мышьяку, реагирует только с галогенами. При нагревании на воздухе она сгорает с образованием Sb203, а с металлами образует сплавы или нестехиометрические твердые растворы.
Сурьма применяется в основном в сплавах, и в частности в типографском сплаве — гарте для увеличения твердости и износостойкости литер при пе"ти. Сурьма входит в состав ряда лекарственных препаратов. Растворимые соединения сурьмы ядовиты.
Висмут. Висмут — хрупкий при комнатной температуре металл, блеск которого имеет заметный красноватый оттенок. Выше 120 °C он становится ковким и пластичным.
В компактном виде висмут при стандартных условиях не реагирует с другими элементами, хотя подвергается поверхностному окислению. В виде порошка он сгорает в атмосфере галогенов с образованием тригалогенидов. При сильном нагревании в кислороде или на воздухе висмут образует оксид Bi203. С металлами, даже щелочными и щелочноземельными, висмут не образует стехиометрических соединений. В своих соединениях, в отличие от более легких элементов, висмут почти исключительно находится в степени окисления +3.
Основное применение висмута — получение легкоплавких сплавов.
В заключение общего обзора химических свойств элементов V группы рассмотрим их реакции с азотной кислотой, которые хорошо отражают изменение кислотно-основных свойств в ряду P-Bi. Все эти элементы не реагируют с обычными неокисляющими кислотами — соляной, уксусной и даже хлорной, окислительные свойства которой в растворах заторможены кинетически. Кислоты-окислители реагируют с ними, но продукты окисления различны. Так, азотная кислота, особенно при нагревании, легко реагирует со всеми этими элементами: 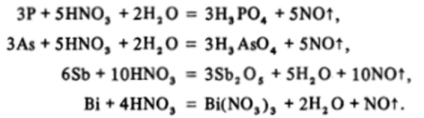
При этом неметаллические фосфор и мышьяк окисляются до соответствующих ортоформ высших кислот, полуметаллическая сурьма — до гидратированной формы высшего оксида Sb205 • лН20, а металлический висмут — только до катиона Bi3 *.