Окислительно-восстановительные реакции в водных растворах

Однако при комнатной температуре эта реакция практически полностью заторможена. Из значений Е'? и? щ видно, что в кислой среде наиболее сильным восстановителем является металлический галлий, а в щелочнойалюминий, который восстанавливает, например, ионы NO2 и N03 до аммиака (см. разд. 23.5). Хотя соединения низших степеней окисления могут быть получены для всех элементов третьей группы… Читать ещё >
Окислительно-восстановительные реакции в водных растворах (реферат, курсовая, диплом, контрольная)
Хотя соединения низших степеней окисления могут быть получены для всех элементов третьей группы, но в водном растворе они диспропорционируют и устойчивы лишь состояния М (1П) и только для таллия — Т1(1). Так, для индия стандартные потенциалы переходов в кислой среде равны (?°, В):
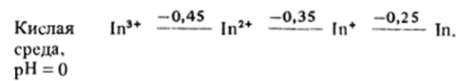
Из этих данных видно, что и In2* и In* должны диспропорционировать на In3* и In, который, в свою очередь, должен растворяться в кислоте с выделением водорода. Таким образом, единственным реальным превращением, претерпеваемым металлом в кислой среде, является переход в состояние М3* (водн), а в щелочной — в состояние М (ОН)^или М (ОН) хотя обычно в таблицах потенциалов для щелочной среды приводятся потенциалы перехода в форму М (ОН) 3 :
В. | Л1. | Са. | In. | TI. | |
??м*7м, в. | — 0,87*. | — 1,62. | — 2,40. | — 0,34. | +0,71. |
?щМ (ОН)3/М. В. | — 1,79. | — 2,30. | — 1,22. | — 1.00. | 0.34 ••. |
- * Переход Н5ВОэ/В.
- •• Переход TIOH-TI.
В соответствии с положением в периодической системе для таллия более характерно состояние Tl (I) и потенциал перехода Т13* +2е≅Т1 ?*? = +1,24 В столь положительный, что Т13+ должен окислять кислород воды, что и делает этот ион термодинамически неустойчивым в водных растворах: 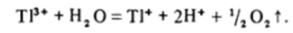
Однако при комнатной температуре эта реакция практически полностью заторможена. Из значений Е'? и? щ видно, что в кислой среде наиболее сильным восстановителем является металлический галлий, а в щелочнойалюминий, который восстанавливает, например, ионы NO2 и N03 до аммиака (см. разд. 23.5).
ГАЛОГЕНИДЫ И ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
При более или менее сильном нагревании, необходимом для преодоления активационного барьера, все элементы III группы экзотермически реагируют со всеми галогенами. Тригалогениды таллия при нагревании легко восстанавливаются до моно галогенидов, отщепляя галоген. Интересно отметить, что Т113 не является иодидом Tl (III), а содержит полииодидный анион 13и Т1*.
Все тригалогениды бора — легколетучие вещества с молекулярным типом кристаллической решетки. В газовой фазе это плоские треугольные молекулы с более высокой кратностью связи за счет вклада пр_р- составляющей в результате взаимодействия неподеленных пар галогена и вакантной рорбитали бора.
Фториды остальных элементов по характеру связи приближаются к ионным соединениям с высокими координационными числами атомов металлов. Это твердые, кристаллические, труднолетучие вещества.
Для остальных тригалогенидов координационная насыщенность достигается за счет димеризации. Например, в газовой фазе галогениды алюминия димерны — А12С16, А12Вг6, А1216. Такие молекулы включают мостиковые атомы галогенов:

Атом металла в состоянии sp3-гибридизации находится в центре несколько искаженного тетраэдра. Три орбитали образуют двухцентровые двухэлектронные связи с тремя атомами хлора, а четвертая, вакантная, взаимодействует по донорно-акцепторному механизму с неподеленной парой одного из атомов хлора второй молекулы.
При наличии других донорных частиц легко образуются ионные комплексы или молекулярные аддукты:
Одно из таких комплексных соединений Na3AlF6 — криолит, в котором алюминий находится в состоянии sp3d2-гибридизации, — используется в процессе электролитического получения металлического алюминия.
Координационная ненасыщенность три галогенидов бора, алюминия, галлия делает их прекрасными катализаторами ряда органических реакций.
Еще один важный класс соединений элементов III группы — кристаллические полупроводниковые вещества, продукты их взаимодействия с элементами V группы. В литературе этот класс соединений часто обозначают как AII]IBV (соединения, а три бэ пять). Нетрудно увидеть, что соединение, образованное элементами третьей и пятой групп одного периода, изоэлектронно простому веществу IV группы. Например, арсенид галлия изоэлектронен германию, а нитрид бора — углероду.
В кристаллическом состоянии соединения А^В^ образуют решетки, подобные алмазной, с чередующимися атомами, А и В, и такие кристаллы обладают хорошими полупроводниковыми свойствами.
Нитрид бора, как и углерод, существует в двух модификациях — чешуйчатой, подобной графиту, и алмазоподобной, которая по твердости не уступает алмазу, и сверхтвердые вставки из нитрида бора находят все более широкое применение при изготовлении различных инструментов — резцов, фрез и др.