Гидроксоформы, анионы и катионы

Отсюда возникает два важных следствия. Во-первых, при попытках получить кремниевую кислоту происходит се разрушение с образованием более или менее гидратированного mSiOa лН30, в котором молекулы воды частично замыкают концевые связи, а частично находятся в пустотах кристалла. Во-вторых, поскольку анион SiO*' координационно-ненасыщен, а маленький анион SiOj' несет слишком большой заряд, что… Читать ещё >
Гидроксоформы, анионы и катионы (реферат, курсовая, диплом, контрольная)
Занимая срединное положение между неметаллами и металлами главных подгрупп, элементы IV группы не образуют ни сильных кислот, ни сильных оснований. Вообще простейшие гидроксоформы (кислоты и основания) не характерны для этих элементов, хотя свойства соответствующих анионов и катионов в значительной степени определяют химическое поведение соединений в водных растворах.
В этом разделе мы рассмотрим свойства простых моноядерных ги дрок со производных, анионов и катионов, т. е. частиц, включающих только один атом элемента IV группы, хотя, например, для кремния гораздо более важны полиядерные структуры, которые будут рассмотрены далее в разд. 24.10.
В диоксиде углерода 0=С=0 кратные связи очень прочны, пони;
^ОН жение кратности связи при переходе от С02 к 0=С^ невыгодно, ОН и, хотя диоксид углерода хорошо растворим в воде (171 мл в 100 г Н20 при О °С и 87,8 при 20 °С), основная его масса в растворе находится в виде гидратированного оксида и лишь небольшая часть — в форме угольной кислоты.
В результате всех взаимодействий в системе С02 (г) — Н20 (ж) устанавливается следующая совокупность равновесий (константы указаны для 20 °С) :
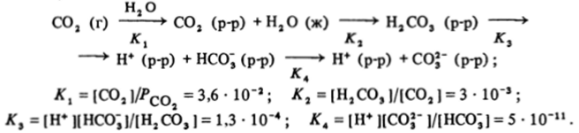
Из этих данных можно сделать несколько выводов: 1) в водном растворе, который находится в равновесии с чистым диоксидом углерода при его парциальном давлении, равном атмосферному, концентрация растворенного С02 невелика и равна 0,036 моль/л; 2) из всего количества растворенного С02 только 0,3% связывается с водой в Н2С03; 3) полагая, что концентрация ионов водорода определяется только первой стадией диссоциации Н2СОэ, находим pH насыщенного раствора С02, который равен ^ 4; 4) при pH = 4 отношение концентраций ионов [С01"] /[НСОз]= 5 * 10″и/1 -КГ7 =5 • КГ4 таково, что концентрацией ионов СОз' по сравнению с HCOJ действительно можно пренебречь.
Вся совокупность равновесий очень чувствительна к значению pH и давлению С02. Так, если рассмотренный выше раствор перевести из контакта с атмосферой С02 в условия контакта с воздухом, rntPco равно не 101 кПа, а всего 0,03 кПа, происходит интенсивное выделение диоксида углерода из раствора, и вся совокупность равновесий смещается влево. Если Вы когда-нибудь открывали бутылку с минеральной водой, то Вы должны были наблюдать этот эффект. Аналогичным образом ведет себя система при уменьшении pH, т. е. при добавлении кислоты. Наоборот, увеличение pH, т. е. добавление к раствору щелочи, смещает всю систему равновесий вправо.
Учитывая, что основная масса диоксида углерода находится в растворе в виде С02, а не в виде кислоты, константу равновесия Ка (1) диссоциации Н2СОэ записывают обычно по отношению к обшей концентрации С02 так, как мы это делал и в случаях с сернистым газом и аммиаком:
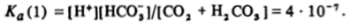
Из всего сказанного ясно, что угольная кислота — слабая кислота и неустойчивое вещество, которое не может быть выделено из водного раствора.
Карбонатный анион СО|" более устойчив, чем молекулы Н2С03. Он существует в отсутствие протонов, т. е. в щелочном растворе или в твердых солях. Но все же при нагревании карбонаты относительно легко разлагаются, например: 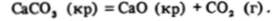
Температура разложения карбоната тем выше, чем более электроположителен элемент, образующий катион, иными словами, чем более ионный характер связи в кристалле.
Это хорошо видно на примере следующего ряда, где для некоторых карбонатов приведены температуры (°С), при которыхРсо =101 кПа:
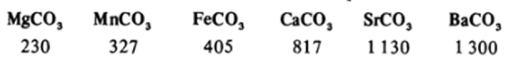
Наиболее ионные карбонаты щелочных металлов испаряются без разложения. Все соответствующие гидрокарбонаты разлагаются легче карбонатов.
В воде растворимы только карбонаты щелочных металлов и аммония. Гидрокарбонаты двухзарядных катионов растворимы, как правило, лучше их карбонатов. Именно поэтому «карбонатное равновесие» играет чрезвычайно важную роль в природе. Все карстовые явления связаны с образованием и разложением гидрокарбоната кальция:
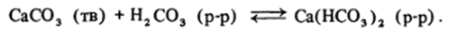
Этим же процессом обусловлена жесткость воды, содержащей гидрокарбонат кальция.
Кремниевая кислота не существует не только в индивидуальном состоянии, но и в растворе. Мы говорили, что Si02 — кристалл с простыми (не кратными) ковалентными связями. Гидратация кислотных оксидов с переходом в кислоты — это, в общем, понижение кратности связи Э=0. Особенно отчетливо это видно на примере перехода S03 в H2S04. Для элементов третьего периода уменьшение кратности связи — обычно процесс энергетически выгодный, но гидратация Si02, в кристалле которого связи не кратные, может привести либо к понижению координацией онного числа и увеличению кратности при переходе к молекуле 0=Siv^,.
что явно невыгодно, либо к сохранению их значений при образовании H4Si04. В этом случае просто связи Si-0-Si заменяются на связи Si-O-Н, что, хотя и не приводит к существенному изменению энергии системы, но все-таки является термодинамически невыгодным процессом.
Отсюда возникает два важных следствия. Во-первых, при попытках получить кремниевую кислоту происходит се разрушение с образованием более или менее гидратированного mSiOa лН30, в котором молекулы воды частично замыкают концевые связи, а частично находятся в пустотах кристалла. Во-вторых, поскольку анион SiO*' координационно-ненасыщен, а маленький анион SiOj' несет слишком большой заряд, что сказывается на поляризации атомов кислорода внутри иона и увеличении отталкивания между ними, существует очень большая склонность к полимеризации тетраэдров Si04 с образованием более сложных полиядерных анионов. Или, иначе, кристалл Si02, состоящий из фрагментов Si04, может образовывать крупные полимерные «осколки», несущие определенный отрицательный заряд.
Соли кремниевой кислоты называются силикатами. За исключением наиболее простых силикатов щелочных металлов, все они нерастворимы в воде. Сплавление Si02 со щелочами или солями щелочных металлов приводит к образованию силикатов и вытеснению более летучих ангидридов кислот. Особенно легко эти реакции идут с карбонатами:
 а
а
Силикаты щелочных металлов, называемые^растворимое стекло, применяются в мыловаренной промышленности, при производстве замазок и клеев.
Формулы M2Si03 отражают только соотношение элементов, но не истинный состав анионов, которые даже в этом случае более сложны. В ряду соединений HC104-H2S04-H3P04 -H4Si04 происходит уменьшение электроотрицательности центрального атома, а значит, сближение полярностей связей во фрагментах Н—О-Э, что в свою очередь приводит к уменьшению кислотных свойств соединений. В этом же направлении действует и увеличение числа гидроксидных групп (см. разд. 16.2). В результате кислотные свойства кремниевых кислот выражены очень слабо, а растворы силикатов щелочных металлов имеют сильнощелочную реакцию из-за глубоко идущего гидролиза, приближенная схема которого может быть записана в виде:
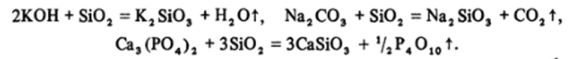
При добавлении кислоты к растворам силикатов равновесие гидролиза сдвигается вправо, что приводит к образованию «кремниевой кислоты», а точнее, гидратированного диоксида кремния:
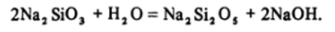
Осаждение кремниевой кислоты из раствора — очень сложный процесс. В зависимости от концентрации растворов, последовательности их сливания, температуры может образоваться либо студневидный осадок, либо гель, либо золь кремниевой кислоты (см. разд. 9.4). Вследствие склонности к полимеризации образование коллоидных систем исключительно характерно для этого соединения.
Германиевая кислота и германаты вполне подобны кремниевой кислоте и силикатам. Точно так же образуется большое число различных анионных форм сложного состава. Простые германаты Na2Ge03 или Li4Ge04 сильно гидролизованы в растворе. Подобно H2Si03 германиевая кислота склонна образовывать коллоидные системы, а в твердом состоянии существует в виде Ge02 • лН20. В отличие от кремниевой кислоты, она несколько растворима в воде, ее растворы имеют кислую реакцию и заметную электропроводимость, что обусловлено диссоциацией ортоформы H4Ge04.
Гидроксопроизводные Sn (IV) и Pb (lV) в воде нерастворимы. Оловянная кислота, а точнее, высокогидратированный диоксид Sn02 • яН20 может быть получен в виде активной формы, растворимой в разбавленных щелочах и кислотах, — так называемой а-оловянной кислоты — осаждением из щелочных растворов при действии кислот. Окисление олова концентрированной азотной кислотой дает малоактивный осадок.
/3-оловянной кислоты, а-, /3-Формы отличаются дисперсностью и содержанием воды.
Состояние Sn (IV) в водных растворах лучше всего передается формулой [Sn (0H)x(H20)6_xJ 4~х, где 0 < 6, и его значение определяется величиной pH: чем больше pH раствора, тем больше х.
Диоксид свинца инертен, и соответствующие ему гидратированные формы неизвестны. Он растворяется в избытке концентрированных щелочей, и из таких растворов могут быть выделены гексагидроксоплюмбаты (1У), например К2[РЬ (ОН)6]. Как будет показано дальше, катионные формы Pb (IV) — настолько сильные окислители, что не могут существовать в кислых растворах.
Такйм образом, мы видим, что для элементов IV группы наблюдается вполне закономерное изменение свойств их гидроксопроизводных. В высшей степени окисления элементы образуют анионные формы, причем не кислоты, а именно анионы: простые оксоанионы углерода СО|"; сложные полиядерные оксоанионы кремния с его непременным тетраэдрическим окружением; оксои гидроксоанионы германия; октаэдрические гидроксоанионы олова и очень неустойчивые гексагидроксоанионы свинца. Единственной реально существующей катионной формой в растворе являются гидроксокатионы олова. Так обстоит дело в случае соединений, в которых элементы находятся в степени окисления +4.
Вспомните, что должно измениться при переходе к соединениям с более низкой степенью окисления. На примере соединений всех трех предыдущих групп мы видели, что понижение положительной степени окисления всегда сопровождается уменьшением кислотных свойств. Точно так же происходит и в IV группе.
Основные свойства у СО практически отсутствуют. Реакция взаимодействия монооксида углерода с водой с образованием муравьиной кислоты, хотя и экзотермична, но идет с уменьшением числа молей газа, а значит, и энтропии. Поэтому уже при стандартных условиях.
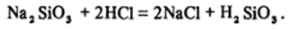
Но все-таки константа равновесия еще не слишком мала (lgК — = -12 000/298 19,14 «-2; /l"0,01), и, если бы не кинетическая инертность СО, то, повышая давление, можно было бы получить достаточно высокие равновесные концентрации муравьиной кислоты. Однако с водой эта реакция не идет, и анион муравьиной кислоты может быть получен только при взаимодействии СО со щелочью при нагревании и, естественно, под давлением: 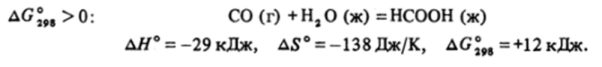
Соли муравьиной кислоты называются формиатами. При действии на раствор формиата натрия рассчитанным количеством рерной кислоты получают раствор летучей муравьиной кислоты, которая может быть отогнана. При обычных условиях — это жидкость, смешивающаяся с водой во всех отношениях.
ду и СО, но энергия активации реакции велика и разложение заторможено. Присутствие водоотнимающих средств (например, H2S04) катализирует распад, и при действии концентрированной серной кислоты НСООН распадается на воду и СО.
Как следует из значения Д (у, муравьиная кислота при комнатной температуре термодинамически неустойчива и должна разлагаться на воПо строению муравьиная и угольная кислоты соотносятся так же, как фосфористая и фосфорная:
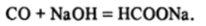
Если сопоставлять действительные константы диссоциации Н2С03 (К= 1,3 • 1(Г4) и НСООН (К = 2 -КГ4), то видно, что обе кислоты практически одинаковы по силе, но по сравнению с обычно принятым для угольной кислоты значением /ГЛ(1) =4 «КГ7 константа диссоциации муравьиной кислоты значительно больше.
Муравьиная кислота и формиаты используются при крашении ж, а ней, в медицине и, в основном, как исходные продукты в органическом синтезе.
Соединения Si (II) — настолько сильные восстановители, что не могут существовать в водных растворах.
Гидроксид германия (II) может быть получен из GeCl2 при его гидролизе или взаимодействии с раствором щелочи:
Это мало растворимое амфотерное вещество, но его раствор подобно раствору Се02 имеет кислую реакцию. Се (ОН)2 растворяется как в избытке кислоты, так и в избыже щелочи с образованием, по-видимому, ги дрок соко мпл ек сов.
Гидроксид олова (II) осаждается при действии щелочей на растворы солей олова (II). Он настолько легко растворим даже в небольшом избыже щелочи с образованием Sn (OH)3 и Sn (OH)4″, что обычно его осаждают, действуя раствором не щелочи, а карбоната:

Это амфотерный гидроксид, практически нерастворимый в воде.
Гидроксид свинца (II) легко осаждается при взаимодействии растворов щелочей с растворами солей свинца — нитрата или ацетата:
Подобно гидроксиду олова (И) PtyOH^ при взаимодействии со щелочами переходит в гидроксоанионы РЬ (ОН)3 или РЬ (ОН)4″, но они устойчивы только в сильнощелочных растворах.
О соотношении кислотных и основных свойств гидроксидов олова (II) и свинца (II) можно судить по значениям их произведений растворимости: 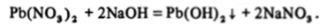
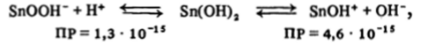
Из этих данных хорошо видны почти идеальная амфотерность Sn (OH)a и отчетливо основные свойства РЪ (ОН),. Поскольку концентрации ионов РЬОН* и ОН" в растворе над осадком РЬ (ОН)3 равны, находим, что (ОН" | = 8 • 10~5 и pH 10, т. е. раствор имеет щелочную реакцию.
Итак, мы видим, что гидроксопроизводные низшей степени окисления элементов IV группы, за исключением муравьиной кислоты, в воде почти нерастворимы. Все они легко теряют воду, превращаясь в соответствующие оксиды. Гидроксид олова (II) амфотерен и одинаково легко образует как гидроксокатион SnOH+, так и гидроксоанион Sn (OH)3, тогда как гидроксид германия (II) дает кислую, а гидроксид свинца — щелочную реакцию в растворе. Это означает, что для германия более характерна анионная, а для свинца — катионная формы существования в водных растворах.