Концентрация растворов.
Химия

Если раствор содержит несколько растворенных веществ, то масса раствора будет складываться из массы всех растворенных веществ и массы растворителя. Массу раствора находим как сумму масс кристаллогидрата и воды, так как они полностью пошли на образование раствора. По формуле (4.1) получим. Как приготовить 0,5 л раствора соляной кислоты концентрацией С (НС1) = = 0,10 моль/л, имея соляную кислоту… Читать ещё >
Концентрация растворов. Химия (реферат, курсовая, диплом, контрольная)
Свойства растворов зависят не только от природы растворенного вещества и растворителя, но и от относительного содержания веществ, т. е. концентрации.
Концентрация — это относительное содержание растворенного вещества.
Применяют разные виды количественного выражения концентрации.
Массовая доля вещества (ш) в растворе — это отношение массы данного вещества к массе всего раствора:

где шх — массовая доля растворенного вещества; тх — масса растворенного вещества; тр — масса раствора.
Масса раствора складывается из массы растворенного вещества и массы растворителя (т2): тр = т1 + т2. Тогда формулу (4.1) можно записать в виде.
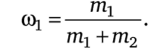
Если раствор содержит несколько растворенных веществ, то масса раствора будет складываться из массы всех растворенных веществ и массы растворителя.
Массовая доля всегда меньше единицы; очевидно, что сумма массовых долей всех компонентов системы (раствора) равна единице:
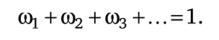
Удобно массовую долю выражать в процентах:

Пример 4.2.
Приготовили раствор из 19 г хлорида натрия и 81 г воды. Найдите массовые доли веществ в растворе.
Пусть NaCl — вещество 1, вода — вещество 2, тогда по формуле (4.1) находим.
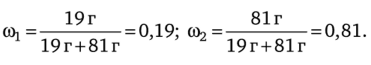
Соли и другие вещества можно растворять в воде как в безводном состоянии, так и в виде кристаллогидратов. Однако массовую долю всегда рассчитывают по содержанию безводного вещества.
Пример 4.3.
В воде массой 81 г растворили 19 г декагидрата сульфата натрия Na2SO4-10H2O. Рассчитайте массовую долю соли в растворе.
При растворении кристаллогидрата в раствор дополнительно вносится вода. Рассчитаем массу безводного вещества, условно полагая, что кристаллогидрат теряет воду:
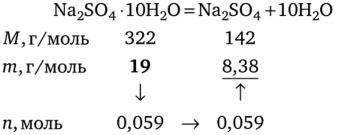
Массу раствора находим как сумму масс кристаллогидрата и воды, так как они полностью пошли на образование раствора. По формуле (4.1) получим.
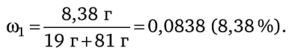
Рассмотрим примеры расчета массы растворенного вещества.
Пример 4.4.
Найдите массу карбоната натрия в растворе объемом 200 мл с массовой долей соли 14%. Плотность раствора 1,146 г/мл.
Из формулы (4.1) выражаем массу растворенного вещества:

Если массовая доля со1 выражена в процентах, формула для расчета массы растворенного вещества будет иметь вид.

Массу раствора рассчитываем по данным условия:
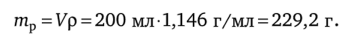
По формуле (4.4) находим.
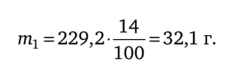
Таким образом, масса карбоната натрия в растворе 32,1 г.
Пример 4.5.
Сколько граммов сахара следует добавить к 180 г раствора с массовой долей 15%, чтобы массовая доля сахара увеличилась до 25%?
При добавлении вещества, уже имеющегося в растворе, увеличивается как масса вещества, так и масса раствора. Сначала рассчитаем массу сахара в растворе, по формуле (4.4) находим.
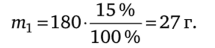
Далее вычисляем массу сахара, который нужно добавить:
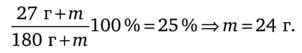
Таким образом, следует добавить 24 г сахара.
При внесении вещества в растворитель может происходить химическая реакция; в результате получается раствор нового вещества.
Пример 4.6.
Сколько граммов натрия следует растворить в 0,5 л воды, чтобы получить 20%-ный раствор гидроксида натрия?
Натрий реагирует с водой, образуя гидроксид натрия и водород.

Плотность воды 1 г/мл, значит, масса воды составит 500 г.
Тогда масса раствора будет равна.
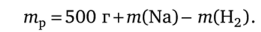
Согласно формуле (4.2) получим.

В этом уравнении три неизвестные величины: m (NaOH), m (Na), m (H2); они связаны между собой уравнением химической реакции.

Решение задачи будем проводить по приведенной ниже схеме, используя следующие обозначения: п0 — число молей исходного реагента (натрия); пк — число молей конечных продуктов (гидроксида натрия и водорода):

Подставляем массы компонентов, выраженные через неизвестное х, в полученное уравнение:

Находим массу натрия: 2,81 моль • 23 г/моль = 64,6 г.
В химии не менее широко, чем массовая доля, используется и другой способ выражения концентрации — молярная концентрация.
Молярная концентрация (С) — это отношение количества вещества в растворе к объему раствора:

где п — количество вещества, моль; V — объем раствора, л.
Размерность молярной концентрации — [моль/л].
Молярная концентрация численно равна количеству растворенного вещества в 1 л раствора. Применение молярной концентрации для расчетов в химии очень удобно, так как непосредственно вычисляется количество вещества в данном объеме раствора:

Пример 4.7.
Сколько граммов соды Na2C03 необходимо для нейтрализации разлившейся серной кислоты объемом 0,5 л концентрацией 6 моль/л? Соду следует взять с избытком 50% от стехиометрического количества.
Напишем уравнение реакции.
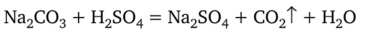
М = 106 г/моль Известно, что.
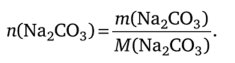
Согласно стехиометрии реакции: n (Na2C03) = n (H2S04). Тогда с учетом уравнения (4.6) получим.
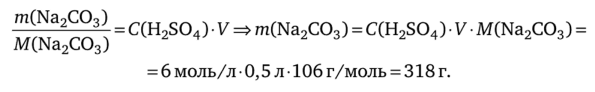
Поскольку требуется 50%-ный избыток, масса соды составит:
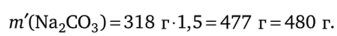
Таким образом, для нейтрализации потребуется примерно 480 г соды.
Концентрацию одного и того же раствора можно выразить разными способами. Поэтому часто возникает необходимость перехода от одного способа к другому.
Пример 4.8.
Рассчитайте молярную концентрацию раствора карбоната натрия с массовой долей 14% (см. пример 4.4).
Для расчета молярной концентрации по формуле (4.5) нужно знать количество вещества и объем раствора. Для простоты расчетов примем V = 1 л (1000 мл). Количество вещества вычисляем по формуле п = т / М. Для расчета нужно знать молярную массу соды:
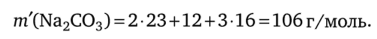
Массу вещества в растворе находим по формуле (4.4) с учетом того, что масса раствора равна.
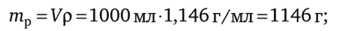
плотность раствора р = 1,146 г/мл дана в примере 4.4.
Далее последовательно проводим расчеты:
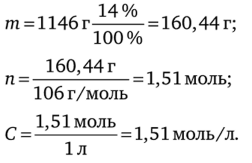
Значит, молярная концентрация раствора C (Na2C03) = 1,51 моль/л.
С помощью примера 4.8 можно вывести общие формулы для пересчета массовых долей в молярную концентрацию:

и массовых процентов в молярную концентрацию:

В заключение рассмотрим примеры расчета растворов с заданной молярной концентрацией.
Пример 4.9.
Как приготовить 2 л раствора хлорида натрия концентрацией C (NaCl) = = 0,155 моль/л?
Рассчитаем массу NaCl, необходимого для приготовления раствора:
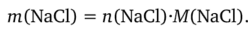
Для этого нужно знать число молей NaCl; эту величину определяем по формуле (4.6):

Далее находим:

Навеску хлорида натрия 18,1 г отмеряют с помощью весов; дальнейшие операции проводят по схеме:
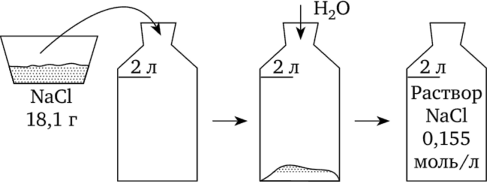
Пример 4.10.
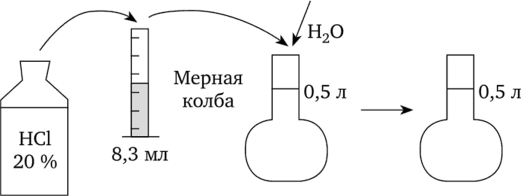
Как приготовить 0,5 л раствора соляной кислоты концентрацией С (НС1) = = 0,10 моль/л, имея соляную кислоту с массовой долей 20% (плотность 1,10 г/мл)?
Вычисляем молярную концентрацию исходной 20%-ной соляной кислоты по формуле (4.8): 
Концентрация этого раствора оказалась больше заданной, поэтому раствор следует разбавить водой.
Найдем количество вещества НС1 в растворе, который будет приготовлен:

Определяем массу НС1:
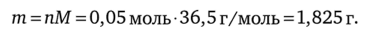
Рассчитаем массу исходного раствора, в котором содержится 1,825 г НС1:

Найдем объем 20%-ного раствора НС1, который требуется взять для разбавления:
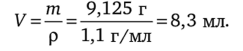
Рассчитанный объем 8,3 мл берут мерным цилиндром и разбавляют водой до 500 мл по схеме:
Вопросы и задания.
- 1. Как рассчитывают молярную концентрацию?
- 2. В чем отличие молярной концентрации от массовой доли?
- 3. В 1 л раствора содержится 20 г хлорида калия и 20 г хлорида магния. Молярная концентрация какой соли больше?
- 4. В 500 г воды растворили 1 моль хлорида натрия и 1 моль хлорида кальция. Массовая доля какой соли больше?
- 5. Массовые доли хлорида натрия и воды, найденные в примере 4.2, выразите в процентах. С какими величинами численно совпали полученные значения массовой концентрации NaCl и Н20, выраженные в процентах; почему это произошло? Сформулируйте правило.
- 5. Как рассчитывают массовую долю растворенного вещества?
- 6. В каких единицах выражают массовую долю?