Хлорсеребряный электрод.
Изготовление биотехнических и медицинских аппаратов и систем

Каломельные электроды имеют другую конструкцию, но по своим характеристикам они также приближаются к абсолютно неполяризуемым электродам. Эти электроды отличаются особой стабильностью и применяются главным образом как референтные электроды при электрохимических измерениях — например, при измерении pH растворов. Каломельный электрод часто изготавливается в виде стеклянной трубки с пористой… Читать ещё >
Хлорсеребряный электрод. Изготовление биотехнических и медицинских аппаратов и систем (реферат, курсовая, диплом, контрольная)
Хлорсеребряный электрод (Ag/AgCl) широко применяется на практике и может быть легко изготовлен в лабораторных условиях. По своим характеристикам он приближаются к абсолютно неполяризуемому электроду. Он принадлежит к тому классу электродов, которые изготавливают из металла, покрытого слоем слаборастворимой соли этого металла с подходящим анионом. Электрод погружается в электролит, содержащий те же анионы в достаточно высокой концентрации.
Структура хлорсеребряного электрода изображена на рисунке 9.5. Основой электрода служит металлическое серебро с припаянным и изолированным соединительным проводом. Снаружи серебро покрыто осаждённой солью AgCl. Эта соль малорастворима в воде, поэтому электрод не разрушается со временем. Электрод погружен в электролит, основным анионом в котором является С1~. Для наилучшего результата раствор электролита должен быть насыщен AgCl, чтобы уменьшить всякую вероятность растворения поверхностной плёнки электрода.
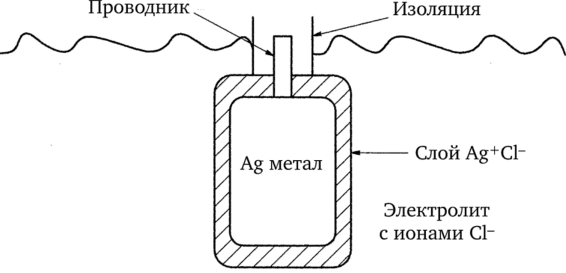
Рис. 9.5. Хлорсеребряный электрод в разрезе Работу хлорсеребряного электрода регулируют две химические реакции. В первой из них происходит окисление атомов серебра на поверхности электрода до ионов серебра в растворе на границе:
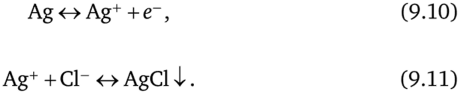
Вторая реакция возникает непосредственно после формирования ионов Ag+. Эти ионы объединяются с ионами СЬ, уже находящимися в растворе, и образуют соль AgCl. Как уже упоминалось выше, AgCl очень слабо растворяется в воде, так что её большая часть оседает на серебряном электроде, увеличивая на нём запас хлорида серебра. Скорость осаждения хлорида серебра и его возврата в раствор равна константе Ks, известной как произведение растворимости. В условиях равновесия ионные активности ионов Ag+ и С1_ должны быть такими, что их произведение равнялось бы этой константе:

В биологических жидкостях концентрация ионов СЬ сравнительно высока, поэтому их активность несколько ниже единицы. Произведение растворимости для AgCl примерно равно 10″10. Это означает, что если Ag/AgCl — электрод находится в контакте с биологическими жидкостями, активность иона Ag+ должна быть очень низкой и примерно того же порядка, что и произведение растворимости.
Мы можем найти электродный потенциал для Ag/AgCl электрода, написав уравнение (9.6) для реакции (9.10):
Используя (9.12), перепишем это уравнение следующим образом:
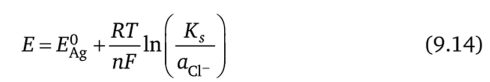
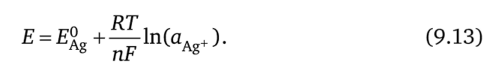
или.
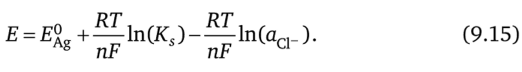
Первое и второе слагаемое в правой части (9.15) являются константами, и только третий член зависит от ионной активности. В рассматриваемом случае это активность иона С1_, которая сравнительно велика и не связана с окислением Ag из-за протекающего через электрод тока. Электродный потенциал этого электрода, следовательно, достаточно стабилен, если он погружен в электролит, содержащий С1_ в качестве основного аниона (при условии, что активность ионов С1_ остаётся постоянной). У живых организмов это условие соблюдено, поэтому хлорсеребряный электрод является стабильным интерфейсом при электрических измерениях в биологии и медицине.
Существует несколько способов получения Ag/AgCl — электрода. Два из них особенно важны для биомедицинских электродов: электролитический и синтеровочный.
При электролитическом способе изготавливают электрохимическую ячейку, в которой серебряный электрод, на котором необходимо сформировать слой AgCl, служит анодом, а другой кусок серебра (значительно больший по площади) служит катодом. Электрический элемент напряжением 1,5 В является достаточным источником энергии для проведения гальванического осаждения хлорида серебра на аноде. При этом ток следует пропустить через ограничительное последовательное сопротивление и миллиамперметр, что даёт возможность управлять интенсивностью реакции, пропорциональной току.
Реакции (9.10) и (9.11) начинают возникать сразу же после подключения батарейки, и ток скачком вырастает до максимального уровня. С ростом толщины слоя AgCl интенсивность реакции уменьшается, приводя к снижению тока. Теоретически ток должен упасть до нуля, как только вся поверхность серебра покроется его солью. На практике этого никогда не происходит, поскольку ток течёт благодаря другим параллельным процессам. Таким образом, реакция может быть остановлена через несколько минут, когда ток достигнет сравнительно стабильного низкого значения (около 10 мкА для большинства биологических электродов).
Второй способ получения хлорсеребряных электродов, полезный для медицинских целей, основан на синтеровочном процессе, в результате которого при спекании металла и его соли формируются компактные гранулированные электроды. Электрод состоит из серебряного проводника, окружённого синтеровочным цилиндром из смеси Ag/AgCl. Этот цилиндр формируется за счёт помещения зачищенного проводника в пуансон, заполняемый порошковой смесью Ag и AgCl. Пуансон зажимается дорновым прессом, который формирует гранулу из порошка. Эта гранула извлекается из пуансона и запекается в течение нескольких часов при 400 °C. Синтеровочные электроды обладают большей прочностью, чем электроды с электролитически осаждённым слоем AgCl. Они допускают многократное применение. Электролитически осаждённый слой AgCl имеет тенденцию к отслоению при механических нагрузках, что обнажает часть металлического Ag, вызывая его непосредственный контакт с электролитом.
Хлорид серебра не является хорошим проводником электрического тока. Если порошок, из которого был изготовлен синтеровочный электрод, состоял только из хлорида серебра, то полученный электрод будет иметь слишком высокое сопротивление. Электрохимики обнаружили, что можно увеличить проводимость гранулы хлорида серебра, добавляя в синтеровочный порошок пудру металлического серебра. Количество металлического серебра слишком мало, чтобы обеспечить прямой контакт серебряной проволоки с раствором (это означало бы разрушение электрохимической системы). Между частицами серебра всегда есть частицы хлорида серебра, препятствующие такому контакту. В то же время частицы металлического серебра существенно облегчают току путь через электрод. В действительности композитный синтеровочный хлорсеребряный электрод весьма похож на своего электролитического двойника. Дело в том, что в реальности осаждённый тонкий слой хлорида серебра остаётся химически чистым только в течение короткого времени после своего образования. Хлорид серебра — это представитель галогенидов, отличающихся светочувствительностью. Свет, падающий на хлорид серебра, восстанавливает катионы серебра до атомов металлического серебра. Таким образом, в действительности электролитически сформированный слой хлорида серебра также содержит частицы чистого серебра. В этом легко убедиться, наблюдая, как быстро этот слой становится тёмно-серым (чистый хлорид серебра имеет жёлтый цвет).
Вдобавок к отсутствию поляризации, Ag/AgCl электрод производит меньше специфического низкочастотного шума, чем электроды из чистого серебра. Действительно, электроды с сохранённым слоем AgCl генерируют существенно меньшее шумовое напряжение, чем те же электроды с удалённым слоем AgCl. Основной шум металлических электродов происходит на низких частотах. Соответственно, наибольшие помехи возникают при записи низкочастотных сигналов (например, ЭЭГ).
Каломельные электроды имеют другую конструкцию, но по своим характеристикам они также приближаются к абсолютно неполяризуемым электродам. Эти электроды отличаются особой стабильностью и применяются главным образом как референтные электроды при электрохимических измерениях — например, при измерении pH растворов. Каломельный электрод часто изготавливается в виде стеклянной трубки с пористой стеклянной пробкой и основанием, заполненным пастой хлорида ртути (каломель, Hg2Cl2), смешанной с насыщенным раствором хлорида калия (КС1). Подобно AgCl, соль Hg2Cl2 малорастворима в воде, так что большая её часть сохраняется в твёрдой форме. Слой металлической ртути с проводящей проволокой внутри помещается поверх слоя пасты. Вся конструкция затем помещается в центр большей стеклянной трубки с пористой стеклянной пробкой в основании. Эта трубка наполняется насыщенным раствором КС1, так что слой Hg2Cl2 внутренней трубки находится в контакте с электролитом через пористую пробку внутренней трубки. Таким образом получают электрод (полуячейку, полуэлектрод), состоящий из металлической ртути, контактирующей со слоем Hg2Cl2, который в свою очередь контактирует с электролитом, насыщенным КС1. Пористая пробка в основании электродной конструкции используется для осуществления контакта между внутренним раствором КС1 и биологическим раствором, в который погружен электрод. Этот контакт может породить диффузионный потенциал (см. выше), который добавится к электродному потенциалу.
Хлорсеребряные электроды могут быть изготовлены подобно вышеописанным каломельным электродам. Их также можно применять при электрохимических измерениях. В этом случае ртуть заменяют серебром, а каломель — хлоридом серебра.
Используя тот же формализм, что и для Ag/AgCl — электрода, мы можем показать, что электродный потенциал каломельного электрода зависит от активности ионов С1_ в растворе КС1. Поскольку раствор КС1 в наружной стеклянной трубке является насыщенным, концентрация ионов С1- в нём постоянна. Значит, при постоянной температуре электродный потенциал каломельного электрода постоянный. На практике пористый кончик каломельного электрода погружают в биологический раствор. При измерении pH в стеклянный стаканчик погружают два электрода — один каломельный (референтный), а другой — селективный для ионов водорода.