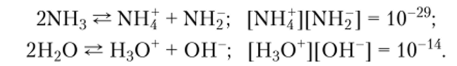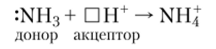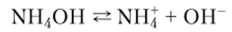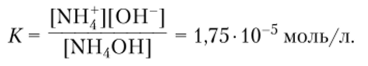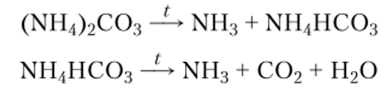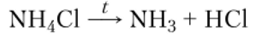Чистый жидкий аммиак подобно воде способен к диссоциации, но ионное произведение у него гораздо меньше, чем у воды:
Образующиеся катион аммония NHj и амид-ион NII2 аналогичны катиону оксоиия Н30+ и гидроксид-иону ОН".
Катион аммония NH4 образуется по донорно-акцепторному механизму:
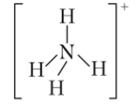
Он имеет форму правильного тетраэдра:
Гидроксид аммония NH4OH обычно рассматривают как слабое основание.
с константой диссоциации:
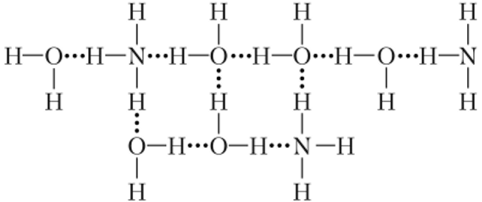
Однако в действительности это соединение в водных растворах не существует. Водные растворы аммиака, как разбавленные, так и концентрированные, представляют собой специфические системы. В этих растворах молекул NH4OH или соединений NH3 H20 нет как таковых, а существуют связанные водородными связями в нерегулярную трехмерную структуру молекулы аммиака и воды:
Появление в водном растворе аммиака катионов NH| и гидроксид-ионов ОН объясняется тем, что молекула NH3 прочнее связывает катион Н+, чем молекула Н20.
Соли аммония во многом аналогичны солям щелочных металлов, особенно солям калия, так как радиус катиона NH| (151 пм) почти равен радиусу катиона К+ (152 пм). ЛСобразования ионных решеток солей аммония сравнимы с А (70бразования ионных решеток солей калия. Соли аммония редко содержат кристаллизационную воду, но всегда хорошо растворимы в воде. Вместе с тем они заметно отличаются от солей щелочных металлов способностью катиона NH4 отщеплять протон. Поэтому соли аммония и летучих кислот возгоняются с разложением при невысоких температурах. При этом чем слабее кислота, тем легче возгоняются аммонийные соли этой кислоты. Легкость возгонки связана с силой кислот, потому что возгонка происходит с полной диссоциацией соли на NH3 и соответствующую летучую кислоту. Так, например, карбонат аммония (NH4)2C03 неустойчив уже при комнатной температуре:
а хлорид аммония NH4C1 возгоняется только при температурах выше 250°С:
Наконец, соли аммония иначе, чем соли щелочных металлов, ведут себя в водных растворах. Соли аммония испытывают гидролиз по катиону. При этом, естественно, гидролиз протекает сильнее, если соль образована слабой кислотой. Соли аммония со слабыми кислотами, таким образом, неустойчивы и термически, и гидролитически.