Хлор.
Неорганическая химия

Хлорная кислота, перхлораты. В отличие от остальных кислородсодержащих кислот хлора хлорная кислота НСЮ4 может быть получена в виде индивидуального вещества. Чистая хлорная кислота представляет собой бесцветную, сильно дымящую на воздухе жидкость. Она устойчива в водных растворах, в чистом виде взрывоопасна. Хлорная кислота — одна из самых сильных кислот. Она превосходит по силе азотную… Читать ещё >
Хлор. Неорганическая химия (реферат, курсовая, диплом, контрольная)
Элементное состояние. В обычных условиях хлор — желтозеленый газ с резким раздражающим запахом, очень токсичный, разрушительно действующий на дыхательные пути. При обычных температурах газообразный хлор под действием небольшого давления легко превращается в желтую жидкость (бм 34 °C, ?кип 10ГС).
Химические свойства. Хлор — сильный окислитель. Он имеет самое высокое сродство к электрону из всех химических элементов. Однако энергии связей в хлоридах ниже, чем энергии связей во фторидах (см. параграф 21.1), а энергия а-связи в молекуле CI2 (243 кДж/моль) существенно больше, чем энергия ст-связи в молекуле F2 (155 кДж/моль). Поэтому газообразный хлор как окислитель сильно уступает фтору, но одновременно превосходит молекулярный кислород. В хлоре окисляются все простые вещества, за исключением углерода, азота, кислорода и благородных газов. При этом хлор как окислитель часто действует уже при обычных температурах и быстрее, чем кислород.
Получение. В лабораторных условиях хлор получают действием концентрированной хлороводородной кислоты на диоксид марганца:
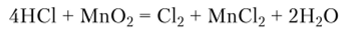
В промышленности хлор получают электролизом концентрированных водных растворов NaCl. Его хранение осуществляют в стальных баллонах, где он находится в жидком состоянии.
Бинарные соединения. По строению они аналогичны бинарным фторидам, но менее разнообразны (табл. 21.6). Хлор не образует хлоридов с электроотрицательными элементами, в которых стабилизируются высшие степени окисления этих элементов. Среди соединений хлора с элементами второго и третьего периодов большинство относится к числу ковалентных.
Бинарные соединения хлора с элементами второго и третьего периодов и их значения AGy- 298 (кДж/моль).
LiCl (K). — 384,3. | ВеС12(к). — 468. | ВС13(г). — 387,2. | СС14(ж). — 68,6. | КС13(ж). +235. | ОС12(г). +93,4. | FCl®. — 51,4. |
NaCl (K). — 384,0. | MgCl2(K). — 591,6. | АЮ13(к). — 628,6. |
| РС13(ж). — 260,5. |
| С12(г). |
РС15(к). — 297,3. | 8С14(ж) -56, i. Д///, 298. | |||||
Ионные кристаллы. | Ковалентные молекулярные соединения. | |||||
Все молекулярные соединения хлора подвергаются гидролизу с образованием кислот и хлороводорода, например:
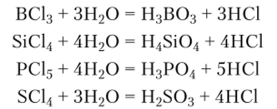
Ионные хлориды металлов можно рассматривать как соли хлороводородной кислоты.
Хлороводород. Это бесцветный газ с резким запахом, очень хорошо растворимый в воде. Молекула НС1 слабополярна и имеет меньшую ионность связи (18%), чем HF (42%). Энергия ст-связи НС1 равна 432 кДж/моль, что гораздо меньше, чем энергия ст-связи HF (563 кДж/моль), поэтому в водных растворах IICI проявляет свойства сильной кислоты и диссоциирует на ионы полностью.
Водный раствор хлороводорода — сильная одноосновная хлороводородная кислота. Концентрированная хлороводородная кислота — бесцветная, дымящая на воздухе жидкость. НС1 в воде полностью диссоциирует на ионы:
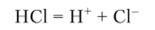
Соли хлороводородной кислоты — хлориды.
Большую часть хлороводородной кислоты в промышленности получают как побочный продукт, образующийся, например, при хлорировании органических соединений и производстве не содержащих хлора калийных удобрений. Меньшее значение имеют синтез из простых веществ и взаимодействие хлорида натрия с концентрированной серной кислотой:
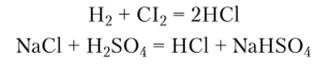
Хлороводородная кислота растворяет все металлы, имеющие отрицательные стандартные электродные потенциалы. При этом образуются водород и хлорид соответствующего металла:
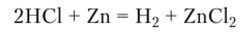
НС1 также реагирует со многими оксидами и гидроксидами:
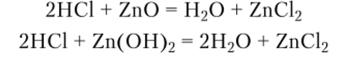
В результате этих реакций также образуются хлориды металлов.
Известны хлориды всех s-, p- и ^/-металлов. Свойства этих солей довольно разнообразны и зависят от природы металла и степени его окисления. Хлориды щелочных металлов — хорошо растворимые в воде вещества, кристаллизующиеся из насыщенных растворов в безводном состоянии (см. табл. 15.5). Только LiCl образует кристаллогидраты, которые теряют воду при температуре около 100 °C. Хлориды бериллия, магния и щелочноземельных металлов образуют в воде растворы с очень высокими концентрациями насыщения (см. табл. 16.6). Эти соли известны в виде кристаллогидратов с большим числом молекул воды: ВеС12-4Н20, MgCl2-6H20, СаС12-6Н20. В растворах ВеС12 и MgCl2 частично гидролизуются. При прокаливании кристаллогидраты ВеС12-4Н20 и MgCl2-6H20 гидролизуются полностью и выделяют НС1. Безводный хлорид кальция СаС12 используют как эффективное водоотнимающее средство. Соли типов А1С13-6Н20, FeCl3-6H20, FeCl2-4H20 в водных растворах и при прокаливании ведут себя аналогично ВеС12 -4Н20 и MgCl2 -6II20.
Оксиды. Соединения хлора с кислородом термодинамически неустойчивы. Они не могут быть получены синтезом из простых веществ. Их получают косвенным путем, часто с использованием реакций диспропорционирования.
При обычных условиях существуют пять оксидов хлора: С120, СЮ2, С1204, С12Ое и С1207. В трех из них хлор проявляет характерные для галогенов нечетные степени окисления. Это С120 и С1207, а также С1204, строение которого более правильно отражает формула С1—О—С103 (в этой молекуле у каждого из двух атомов хлора своя степень окисления). Еще в двух оксидах: CIO2 и С1206 у хлора необычные четные степени окисления.
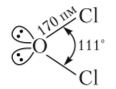
Монооксид дихлора [оксид хлора (1)| С120 — желто-оранжевый газ с запахом хлора. Молекула монооксида дихлора имеет угловую форму с sp-гибридизацией электронных орбиталей атома кислорода, угол С1—О—С1 близок к тетраэдрическому:
Получают С120 при пониженной температуре, пропуская газообразный хлор над оксидом ртути (П):
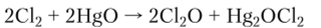
При комнатной температуре С120 неустойчив и распадается:
![Диоксид хлора [оксид хлора(1У)] С102 — желтый газ. Молекула СЮ2 имеет угловую форму:](/img/s/8/96/1513396_9.png)
Диоксид хлора [оксид хлора (1У)] С102 — желтый газ. Молекула СЮ2 имеет угловую форму:
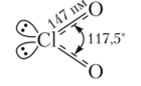
Центральный атом хлора имеет нссвязывающую электронную пару и один неспаренный электрон, который оказывает существенное влияние на свойства этого оксида хлора. Благодаря наличию неспаренного электрона для СЮ2 характерна тенденция к присоединению электрона:
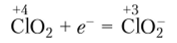
Поэтому диоксид хлора — сильный окислитель.
При взаимодействии с водными растворами сильных оснований диоксид хлора диспропорционирует с образованием хлорит-ионов С102 и хлорат-ионов CIO3:
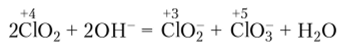
В отличие от остальных оксидов хлора СЮ2 производят в промышленных масштабах путем действия восстановителей на соли хлорноватой кислоты — хлораты: 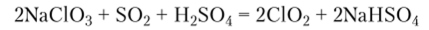
Учитывая возможность взрыва при транспортировке, его чаще всего получают непосредственно на месте применения. СЮ2 используют вместо хлора для водоподготовки, обеззараживания сточных вод и отбеливания целлюлозы при производстве бумаги, так как он менее опасен для окружающей среды и в противоположность хлору не дает канцерогенных соединений с содержащимися в воде органическими веществами.
Перхлорат хлора С1—О—СЮ3 — светло-желтая жидкость (?пл = -И7°С, ?кип = 44,5°С). Это вещество — производное хлорной кислоты, все химические связи в нем имеют преимущественно ковалентный характер. Оно неустойчиво и при комнатной температуре медленно разлагается:
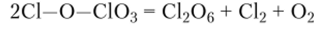
Гексаоксид дихлора [оксид хлора (У1)| С1206 — ярко-красная жидкость (?пл = 3°С). Твердый С1206 имеет кристаллическую структуру и состоит из ионов СЮ+ и СЮ4. Получают его при окислении диоксида хлора озоном:
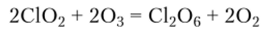
Этот оксид также нестойчив и начинает разлагаться уже при температурах О—10°С:
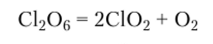
С1206 интенсивно взаимодействует с водой, при этом он диснронорционирует с образованием хлорноватой НСЮ3 и хлорной IICIO4 кислот:
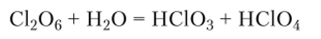
Гептаоксид дихлора [оксид хлора (УП)| С1207 — бесцветная подвижная жидкость (?пл = -93,4°С, ?кип = 87°С). Молекула С1207 состоит из двух искаженных тетраэдров СЮ4, имеющих один общий атом кислорода:
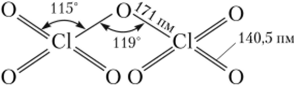
Этот оксид хлора получают при обезвоживании хлорной кислоты сильными водоотнимающими средствами, такими, как олеум или PiO^: 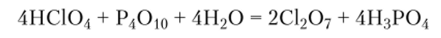
CI2O7 неустойчив: при нагревании под давлением и от удара взрывается. С водой он не смешивается, их взаимодействие происходит на границе раздела фаз, при этом образуется хлорная кислота:
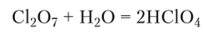
Кислородсодержащие кислоты хлора и их соли. В кислородсодержащих кислотах хлор проявляет типичные для галогенов нечетные степени окисления: +1, +3, +5 и +7.
Хлорноватистая кислота, гипохлориты. Хлорноватистая кислота НОС1 — неустойчивое соединение, существующее в водных растворах (максимальное содержание — около 30%) и газообразном состоянии. Молекула хлорноватистой кислоты имеет угловую форму.
Хлорноватистая кислота — слабая одноосновная кислота; К = 3,9 • 10 8. В водных растворах IЮС1 устанавливаются два равновесия:
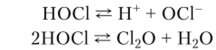
В небольших количествах хлорноватистая кислота всегда присутствует в водном растворе хлора — так называемой хлорной воде:
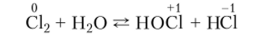
Равновесие этой реакции смещено влево. Для получения более концентрированных растворов НОС1 в воду добавляют мелкодисперсный оксид ртути HgO, который связывает I1C1 и тем самым способствует смещению равновесия вправо и накоплению в растворе НОС1.
В водных растворах НОС1 разлагается с выделением 02, который образуется из атомарного кислорода:
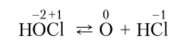
Скорость этой внутримолекулярной окислительно-восстановительной реакции увеличивается при освещении. В присутствии хлороводородной кислоты протекает быстрая реакция компропорционирования:
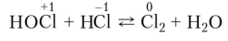
Образующиеся в результате этих реакций хлор и атомарный кислород обладают очень сильным дезинфицирующим и отбеливающим действием. На этом основано использование растворов солей хлорноватистой кислоты, в которых вследствие гидролиза много НОС1, в качестве дезинфицирующих и отбеливающих средств.
Соли хлорноватистой кислоты — гипохлориты. Их получают при взаимодействии газообразного хлора и гидроксида соответствующего металла. За исключением гипохлорита кальция Са (СЮ)2, все гипохлориты очень неустойчивы. Многие из них существуют только в водных растворах. Некоторые гипохлориты можно выделить в виде кристаллогидратов. При обезвоживании они взрываются.
Промышленность в больших количествах производит хлорную или белильную известь, содержащую гипохлорит кальция. Для ее получения используют реакцию между гидроксидом кальция и хлором:
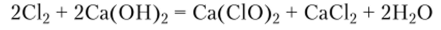
Качество хлорной извести оценивают по содержанию «активного хлора», т. е. хлора, который выделяется при ее обработке хлороводородной кислотой:
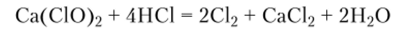
Хлорноватистая кислота и гипохлориты — сильные окислители. Они окисляют в водных растворах многие вещества. Например, нитриты окисляются ими до нитратов, сульфиты — до сульфатов.
Хлористая кислота, хлориты. Подобно хлорноватистой, хлористая кислота НСЮ2 неустойчива и существует только в водных растворах.
Хлористая кислота — слабая одноосновная кислота. Однако она сильнее хлорноватистой: К = 1,1 • 10-2. Соли хлористой кислоты — хлориты, например хлорит натрия NaCl02, который в промышленности под названием «текстон» применяют для отбеливания тканей. Хлорит-ион С102 имеет угловую форму. Хлориты токсичны.
Хлористая кислота и хлориты — сильные окислители.
Хлорноватая кислота, хлораты. Подобно НСЮ и НСЮ2, хлорноватая кислота НС103 неустойчива. Она существует только в водных растворах (максимальное содержание около 30%). Хлорноватая кислота — сильная одноосновная кислота. Ее соли — хлораты, например хлорат калия KCIO3 (бертолетова соль). Хлорат-ион CIO3 имеет пирамидальное строение. Хлорноватая кислота и хлораты — окислители. Они легко восстанавливаются до хлорид-ионов СГ:
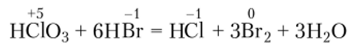
Хлораты магния и кальция Mg (C103)2 и Са (СЮз)2 применяют в качестве гербицидов сплошного действия: они уничтожают все растения, в меньших дозах действуют как дефолианты. Бертолетова соль KCIO3 входит в состав спичечных головок, зажигающихся от трения. Хлораты взрывоопасны (особенно при контакте с восстановителями) и токсичны.
Хлорная кислота, перхлораты. В отличие от остальных кислородсодержащих кислот хлора хлорная кислота НСЮ4 может быть получена в виде индивидуального вещества. Чистая хлорная кислота представляет собой бесцветную, сильно дымящую на воздухе жидкость. Она устойчива в водных растворах, в чистом виде взрывоопасна. Хлорная кислота — одна из самых сильных кислот. Она превосходит по силе азотную и хлороводородную кислоты. Соли хлорной кислоты — перхлораты, например перхлорат натрия ЫаСЮ4. Перхлораты большинства металлов, подобно нитратам, — хорошо растворимые в воде соли. Исключение составляет перхлорат калия КСЮ4. Перхлорат-ионы СЮ4 имеют форму правильных тетраэдров.
Безводная хлорная кислота и кристаллические перхлораты — сильные окислители. Концентрированные водные растворы НСЮ4 используют для «влажного сожжения» при анализе органических веществ. Перхлорат аммония NH4C104 применяют как окислитель твердого ракетного топлива.
В перхлоратах щелочных и щелочноземельных металлов очень велика массовая доля кислорода. Реакции их термического разложения используют в качестве источников кислорода для дыхания в замкнутых помещениях:
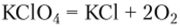
Если сопоставить свойства кислородсодержащих кислот со структурой их молекул, то можно отметить следующее: с ростом степени окисления хлора уменьшается число несвязывающих электронных пар и происходит постепенное достраивание кислородного окружения хлора до тетраэдрического:
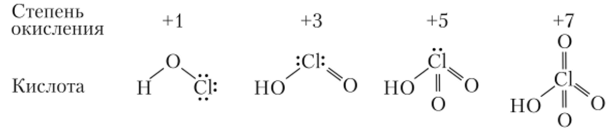
В этом же направлении повышается устойчивость (кинетическая, но не термодинамическая!) и увеличивается сила кислот.