Продукты окислительно-восстановительных реакций

Предсказание продуктов окислительно-восстановительных реакций — это довольно сложная проблема, решение которой начинается с определения продуктов, термодинамически устойчивых в данной системе. Таблица стандартных восстановительных потенциалов позволяет легко определить, в каком направлении термодинамически возможна окислительно-восстановительна я реакция при условиях, близких к стандартным… Читать ещё >
Продукты окислительно-восстановительных реакций (реферат, курсовая, диплом, контрольная)
Предсказание продуктов окислительно-восстановительных реакций — это довольно сложная проблема, решение которой начинается с определения продуктов, термодинамически устойчивых в данной системе. Таблица стандартных восстановительных потенциалов позволяет легко определить, в каком направлении термодинамически возможна окислительно-восстановительна я реакция при условиях, близких к стандартным.
Реакция должна самопроизвольно пойти в том направлении, для которого разность потенциалов Д?° положительна. Окислителем в реакции будет окислитель с большим потенциалом, а восстановителем — восстановитель с меньшим потенциалом.
Например, в упомянутом выше элементе Даниэля — Якоби взаимодействуют две сопряженные пары:

Вторая пара имеет больший потенциал, следовательно, присутствующий в ней окислитель Си2+ будет играть роль окислителя в суммарном процессе, восстановителем же в нем будет Zn — восстановитель из сопряженной пары с меньшим потенциалом. Каждую полуреакцию в таблицах стандартных восстановительных потенциалов принято записывать как полуреакцию восстановления окисленной формы, следовательно, в суммарном процессе полуреакция восстановления окислителя пойдет в прямом направлении, а полуреакция окисления восстановителя — в обратном. Соответственно, разность потенциалов для суммарного процесса получается вычитанием потенциала полуреакции с участием восстановителя из потенциала полуреакции с участием окислителя.
Для окислительно-восстановительной реакции в элементе Даниэля — Якоби эта разность 0,34 — (-0,76) = 1,10 В положительна и равна приведенному выше экспериментальному значению.
По мере протекания окислительно-восстановительной реакции исходные вещества будут расходоваться, а продукты накапливаться, если они естественным путем (например, за счет осаждения или улетучивания) или искусственно не будут удаляться из сферы реакции. При этом восстановительный потенциал окислителя будет уменьшаться, а потенциал восстановителя — увеличиваться, пока они не сравняются и не будет достигнуто состояние равновесия.
Таким образом, при протекании окислительно-восстановительной реакции система приближается к состоянию равновесия, при котором AG = 0 и АЕ = 0. Эта ситуация уже рассмотрена в гл. 12 для любых химических процессов, включая, естественно, и окислительно-восстановительные реакции. Здесь остается лишь добавить, что практический критерий возможности самопроизвольного протекания реакции AG^gg < ~50 кДж преобразуется в АЕ° > 0,5 В. Соответственно, окислительно-восстановительная реакция между сопряженными парами, имеющими близкие значения Е°, не может пройти «до конца» — до полного израсходования исходных веществ. Например, для реакции 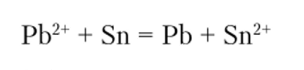
АЕ° = 0,01 В (AG°298 «-4 кДж), и, очевидно равновесие установится при соизмеримых концентрациях ионов свинца и олова в растворе.
Остановимся теперь на достаточно распространенном случае, при котором окислитель или восстановитель (или тот и другой) имеют несколько последовательных продуктов восстановления или окисления соответственно. В подобных случаях возникает вопрос, на какой стадии остановится окислительно-восстановительный процесс. Рассмотрим несколько конкретных примеров.
Окислитель — Fe3+, восстановитель — H2S03, условия стандартные. В принципе, окислитель может восстановиться до Fe24 или Fe в соответствии со схемой, в которой над соединительными линиями приведены значения соответствующих стандартных потенциалов в вольтах (такая схема носит название схемы Латимера).
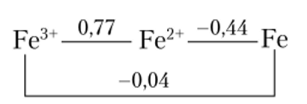
Восстановитель же может быть окислен только до H2S04:
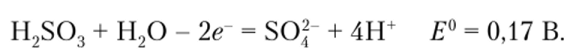
Очевидно, что сернистая кислота может восстановить Fe34 лишь до Fe24 не только в стандартных условиях, но и при любом разумном соотношении концентраций реагентов. Чтобы восстановить Fe34 до Fe, нужен очень сильный восстановитель с потенциалом ниже -0,44 В.
Возьмем теперь восстановитель, который может быть последовательно окислен до нескольких продуктов, например ион Г. Схема стандартных потенциалов иода в кислом растворе следующая:
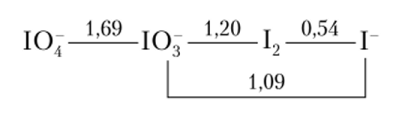
и мы собираемся двигаться по ней справа налево. Прямое сопоставление потенциалов показывает, что, скажем, Сг202 (Е° =1,33 В) может окислить 1″ до Ю3, но не до Ю4, а Вг2 (Е° =1,07 В) — только до 12. Однако, если Вг2 взят в большом избытке, то ввиду близости потенциалов Вг/Вг2 и Ю3/Г возможно частичное окисление I до Ю3.
Частным случаем окислительно-восстановительной реакции является окислительно-восстановительное диспропорционирование. Вопрос о его возможности, естественно, также решается на основании сравнения соответствующих потенциалов. Например, последовательное восстановление Си24 до металлической меди можно изобразить схемой 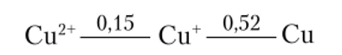
Возможно ли диспропорционирование Си+ по реакции 2Cu+ = Си2+ + Си в растворе, содержащем оба иона меди в концентрации 1 моль/л и находящемся в контакте с осадком металлической меди? Как окислитель Си+ (Си+ + е~ = Си) имеет потенциал 0,52 В, а как восстановитель (Си2+ + е~ = Си*) — 0,15 В, следовательно, АЕ° процесса диспропорционирования больше нуля (0,52 — 0,15 = 0,37 В). Этот процесс термодинамически возможен, и, действительно, ионы Си+ неустойчивы в водных растворах.
В общем случае диспропорционирование промежуточной формы возможно, если потенциал ее восстановления больше, чем потенциал окисления.
В этом параграфе мы рассмотрели термодинамический подход к определению наиболее вероятных продуктов окислительно-восстановительных реакций, но не касались вопроса об их кинетике. Общие соображения в этом отношении сводятся к тому, что быстрее идут гомогенные реакции в растворе, а медленными стадиями могут оказаться образование или разрушение твердой фазы или молекул газа. Зачастую образование тех или иных продуктов в реальных условиях будет определяться скоростью осаждения твердых продуктов или улетучивания газообразных. Ярким примером влияния кинетических факторов на состав образующихся продуктов служат реакции азотной кислоты с металлами (см. параграф 23.5).