Экспериментальная часть.
Определение состава комплексов методом молярных отношений
Для определения констант устойчивости комплексов были исследованы растворы с постоянной концентрацией трифторацетата лантаноида или 2,2'-дипиридила, равной 5,00?10−5 моль/л. В малополярных растворителях и растворителях средней полярности соотношение Ln (III):2,2`-Dipy изменялось от 1:1 (10:1) до 100:1, оптическая плотность растворов регистрировалась при длине волны 309 нм. В полярных… Читать ещё >
Экспериментальная часть. Определение состава комплексов методом молярных отношений (реферат, курсовая, диплом, контрольная)
Определение влияния различных растворителей на устойчивость комплексов Неодима (III) и европия (III) с 2,2?-дипиридилом.
Исходные растворы были приготовлены по навеске, последующие — разведением более концентрированных растворов. Концентрацию 2,2`-дипиридила в растворах изменяли от 1,00· 10-5 моль/л до 1,00· 10-3 моль/л, концентрацию трифторацетатов лантаноидов — от 1,00· 10-5 моль/л до 0,100 моль/л, молярное соотношение Ln (III):2,2`-Dipy — от 100:1 до 1:5.
Электронные спектры растворов 2,2`-дипиридила, трифторацетатов неодима и европия, 2,2`-дипиридила и трифторацетатов лантаноидов при их совместном присутствии в растворах были зарегистрированы в интервале длин волн от 250 нм до 900 нм относительно соответствующего растворителя. В спектрах растворов трифторацетатов лантаноидов полос поглощения не зарегистрировано. Это связано с малыми величинами молярных коэффициентов поглощения лантаноидов и с малой концентрацией растворов.
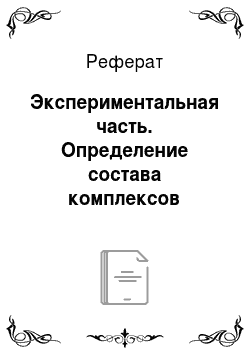
Максимум длинноволновой полосы поглощения в спектрах растворов 2,2`-дипиридила в различных растворителях находился в интервале длин волн от 280 нм до 290 нм. При увеличении полярности растворителей в ряду от малополярного бутилацетата до полярного формамида зарегистрировано батохромное смещение максимума этой полосы поглощения от 282 нм до 288 нм (рис. 2.1).
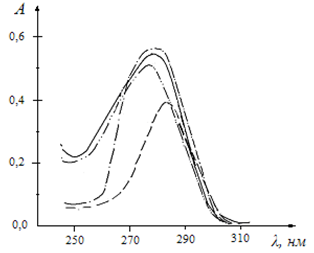

Рисунок 2.1 Полоса поглощения 2,2`-дипиридила в спектрах его растворов в растворителях различной полярности, С2,2'-Dipy = 5,0010−5 моль/л Исходя из молярного коэффициента поглощения в максимуме полосы, равного ~ 1,4· 104моль-1·л·см-1, и из положения в спектре этой полосы, а также, опираясь на известные закономерности, она отнесена к l>р* электронному переходу 2,2`-дипиридила. При введении в растворы 2,2`-дипиридила трифторацетатов лантаноидов, в спектрах большинства растворов появлялась дополнительная полоса поглощения в интервале длин волн от 290 нм до 320 нм. Эта полоса отнесена к поглощению 2,2`-дипиридила, связанного лантаноидами (III) в комплексное соединение (рис. 2.2).
Величина оптической плотности растворов в области максимума данной полосы поглощения использована при определении характеристик комплексообразования. При увеличении в растворах концентрации трифторацетатов лантаноидов, интенсивность этой полосы поглощения увеличивалась, а интенсивность исходной полосы поглощения уменьшалась. При увеличении полярности растворителей отношение интенсивностей полос поглощения связанного в комплексное соединение и свободного 2,2`-дипиридила уменьшалось (рис. 2.2 и 2.3).
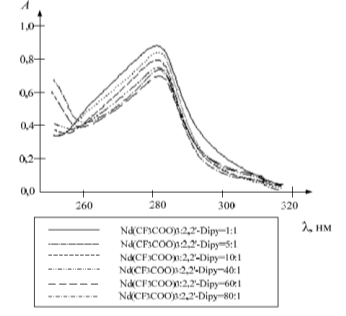
Рисунок 2.3 Спектры поглощения растворов при различном молярном соотношении Nd (III):2,2`-Dipy, система Nd (CF3СОО)3- 2,2?-Dipy-ДМФА, С2,2-Dipy = 5,00· 10-5
Это могло быть обусловлено изменением состояния равновесия в системах, которое привело к уменьшению выхода комплексных соединений, поглощающих электромагнитное излучение при длинах волн больше 300 нм, и к образованию комплексных соединений нового вида. Например, вариант присоединения 2,2`-дипиридила без учета участия молекул растворителя в процессе комплексообразования иллюстрирует схема:
[(CF3СОО)3Ln· 3H2O] + 2,2?-Dipy — [(CF3СОО)3Ln· H2O·2,2?-Dipy](H2O)2 + 2,2?-Dipy -[(CF3СОО)2Ln· 2·2,2?-Dipy](CF3СОО)(H2O)3 ;
-[(CF3СОО)2Ln· 2·2,2?-Dipy]+ + CF3СОО- + 3H2O.
Координационное число лантаноидов в их тригидратах трифторацетатов, с учетом одного монодентатно координированного трифторацетат-иона, равно 8. Как следует из схемы, в процессе реакций его значение не изменяется. В зависимости от полярности растворителей данная схема может иметь варианты внутриили внешнесферного присоединения молекул 2,2`-дипиридила. Отметим, что состав исходного вещества и продуктов реакции, значение к.ч. лантаноидов в их соединениях с трифторуксусной кислотой находят подтверждение в публикациях и косвенно подтверждаются результатами данного исследования. В соответствии с выявленным при анализе спектров различным изменением относительных интенсивностей спектральных полос в области поглощения комплексного соединения, исследованные системы условно разделены на три группы.
В первую группу включены растворы, приготовленные на основе малополярных бутилацетата, этилацетата, метилацетата, а также более полярных гексанола-1, бутанола-1, 2-метилпропанола-1, во вторую — растворы, приготовленные на основе растворителей средней полярности: пропанола-1, пропанола-2, а также более полярного ацетонитрила, в третью — растворы, приготовленные на основе диметилформамида и формамида. Особенностей в спектрах при замене лантаноидов не выявлено.
Влияние свойств растворителей на равновесие комплексообразования лантаноидов (III) с 2,2`-дипиридилом исследовано методом насыщения (рис. 2.4 и 2.5)*.

Рисунок 2.4 Зависимость оптической плотности растворов от молярного соотношения Eu (III):2,2`-Dipy, система Eu (CF3COO)3−2,2`-Dipy-БА, 309 нм.
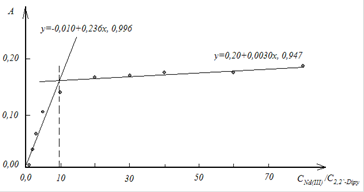
Рисунок 2.5 Зависимость оптической плотности растворов от молярного соотношения Nd (III):2,2`-Dipy, система Nd (CF3COO)3 — 2,2`-Dipy — AN, 309 нм.
* На рисунках приведены уравнения зависимостей А=f (CLn), СLn = n · 10-3 моль/л, С2,2'-Dipy= 5,00 · 10-5 моль/л (рис. 2.4), С2,2'-Dipy= 1,00 · 10-4 моль/л (рис. 2.5).
Для исследования были подготовлены растворы трифторацетата неодима (европия) и 2,2`-дипиридила в соответствующем растворителе с соотношением Ln (III):2,2`-Dipy, изменяющемся от 1:1 (0,2:1 в ДМФА) до 100:1 в бутилацетате, ацетонитриле, диметилформамиде и от 2:1 до 1:5 в воде. Оптические плотности растворов при 309 нм были зарегистрированы относительно соответствующего растворителя. В диметилформамиде, из-за малых величин оптических плотностей растворов в спектральной области больше 300 нм, исследование проводили дифференциальным методом по разности оптических плотностей при 285 нм. В результате исследования выявлено, что с увеличением полярности растворителей положение излома на зависимостях А=f (СLn (III)/С2,2`-Dipy) смещается в область меньших молярных соотношений реагирующих компонентов (табл. 2.1). В этой же последовательности уменьшается угол наклона второго участка зависимости. Это указывает на увеличение общей устойчивости образующихся в растворах комплексных соединений с увеличением полярности растворителей.
Таблица 2.1.
Молярные соотношения Nd (III):2,2`-Dipy, соответствующие точке насыщения в различных растворителях.
Растворитель. | Диэлектрическая проницаемость растворителя, ?? | Молярное соотношение Nd (III):2,2`-Dipy. |
бутилацетат. | 5,1. | |
ацетонитрил. | 35,9. | |
диметилформамид. | 36,7. | |
вода. | 78,3. | 2*. |
* молярное соотношение 2,2'-Dipy:Nd (III).
Оптические плотности растворов трифторацетата неодима (европия) и 2,2`-дипиридила с равными концентрациями каждого из веществ от 5,00?10-5 моль/л до 1,00?10-3 моль/л в отдельных сериях и с молярными соотношениями Ln (III):2,2'-Dipy, изменяющимися от 9:1 до 1:9 в пределах каждой серии, были измерены относительно соответствующего растворителя при длине волны 309 нм. Исследования для отдельных серий растворов повторено через промежутки времени в течение 2 недель.
В результате показано, что в растворах, приготовленных на основе бутилацетата, этилацетата, метилацетата, гексанола-1, 2-метилпропанола-1, бутанола-1, пропанола-2, пропанола-1, ацетонитрила, диметилформамида, воды, в соответствии с увеличением диэлектрической проницаемости растворителей, уменьшается выход комплексных соединений с соотношением Ln (III):2,2`-Dipy, равным 1:1, и увеличивается выход комплексных соединениях с соотношением Ln (III):2,2`-Dipy, равным 1:2. В первой группе растворителей преимущественно образуются комплексные соединения с соотношением Ln (III):2,2`-Dipy, равным 1:1. Значительная ширина зависимостей на изомолярных диаграммах свидетельствует о малой устойчивости комплексных соединений.
Для определения констант устойчивости комплексов были исследованы растворы с постоянной концентрацией трифторацетата лантаноида или 2,2'-дипиридила, равной 5,00?10-5 моль/л. В малополярных растворителях и растворителях средней полярности соотношение Ln (III):2,2`-Dipy изменялось от 1:1 (10:1) до 100:1, оптическая плотность растворов регистрировалась при длине волны 309 нм. В полярных растворителях в качестве аналитической длины волны также использовались длины волн 285 нм, 305 нм и 307 нм, соотношения компонентов изменялись от 1:1 до 1:5. При расчете констант устойчивости, было принято допущение о том, что в растворах образуются простые молекулярные комплексы.
Определение константы устойчивости комплексного соединения европия (III) с 2,2`-дипиридилом методом Бенеши-Гильдебранда рассмотрим на примере системы Eu (CF3COO)3 — 2,2`-Dipy — БА (рис. 2.6). Учитывая результаты метода изомолярных серий, для данной системы была построена зависимость.
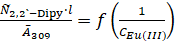
при n=1,.
где n — соотношение комплексообразователь: лиганд;
309 — среднее значение оптической плотности раствора в области максимума полосы поглощения комплексного соединения;

l — толщина поглощающего слоя, см;
С — концентрация, моль/л.
Интервал соотношений компонентов был выбран исходя из величин оптической плотности растворов при аналитической длине волны и коэффициентов линейности зависимостей.
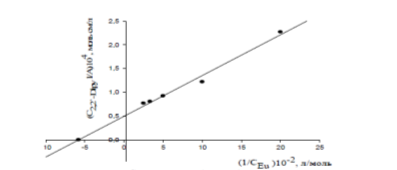
Рисунок 2.6 Зависимость система Eu (CF3COO)3 — 2,2'-Dipy — БА, С2,2'-Dipy = 5,00· 10−5 моль/л, 309 нм, 298 К, y = 0,498+0,086х; r = 0,992.
Константа устойчивости комплексного соединения европия (III) с 2,2'-дипиридилом в бутилацетате была определена графически, по точке пересечения прямой с осью абсцисс, и рассчитана из уравнения Бенеши-Гильдебранда.
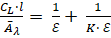
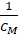
· ,.
где.
К — константа устойчивости комплекса,.
?? — молярный коэффициент поглощения при длине волны л, моль-1· л·см-1.
Ее величина составила (5,8±0,3)· 102. Величина константы устойчивости комплексного соединения неодима (III) с 2,2`-дипиридилом в бутилацетате приведена в таблице 2.2. Полученные результаты в части соотношения величин констант устойчивости комплексных соединений неодима (III) и европия (III) с 2,2`-дипиридилом близки с данными для их растворов в этилацетате.
Значения констант устойчивости комплексных соединений неодима (III), полученные с учетом результатов метода изомолярных серий при одинаковых условиях в других растворителях занесены в таблицу 2.2. Различия в величинах констант устойчивости комплексных соединений с соотношениями Nd (III):2,2`-Dipy, равными 1:1 и 1:2, указывают на принципиальные отличия состава комплексных частиц.
Таблица 2.2.
Константы устойчивости комплексных соединений неодима (III) с 2,2'-дипиридилом в различных растворителях (Sr=0,03, n=4, P=0,95) и физические параметры растворителей, 298 К.
Растворитель. | ЕТ 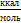 | е. | м· 1030, Кл· м. | АN. | 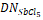 Куст? 10-2 | |
этилацетат. | 38,1. | 6,02. | 6,1. | 9,3. | 17,1. | (6,1±0,3). |
бутилацетат. | 38,5. | 5,1. | 6,15. | 17,4. | (6,8 ± 0,3). | |
метилацетат. | 40,0. | 6,68. | 5,7. | 10,7. | 16,5. | (4,0 ± 0,2). |
ацетонитрил. | 45,6. | 35,9. | 13,09. | 18,9. | 14,1. |
|
пропанол — 2. | 48,4. | 19,9. | 5,54. | 33,6. |
| |
2-метилпропанол-1. | 48,6. | 17,9. | 5,66. | 37,3. | (2,50±0,11). | |
гексанол-1. | 48.8. | 13.3. | (5,0±0,2). | |||
бутанол — 1. | 50,2. | 17,5. | 5,61. | 36,8. | (1,40 ± 0,10). | |
пропанол — 1. | 50,7. | 20,45. | 5,50. | 37,3. | (0,82 ± 0,04). | |
ДМФА. | 43,8. | 36,7. | 12,69. | 16,0. | 26,6. | *(1,20±0,10)· 106. |
формамид. | 56,6. | 12,4. | *(0,75±0,06)· 106. | |||
вода. вода, 0,5 КСl. | 63,1. | 78,3. | 5,9. | 54,8. | (33). |
|
*- константы устойчивости комплексных соединений с соотношением Nd (III):2,2`-Dipy, равным 1:2; Sr=0,05, 292 К.
ЕТ, — универсальный показатель полярности;
е — диэлектрическая проницаемость;
м· 1030, Кл· м — дипольный момент;
АN — акцепторное число;
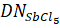
— донорное число.