Метод молекулярных орбиталей

Построив молекулярные орбитали, следует вычислить соответствующую им энергию электронов на основе уравнения Шрёдингера, а далее сравнить ее с экспериментальными данными для соответствующей молекулы. Одновременно вычисляется и межатомное расстояние в молекуле. Линейная комбинация (1) приводит к значению энергии электронов более низкому, чем суммарная энергия электронов в двух отдельных атомах… Читать ещё >
Метод молекулярных орбиталей (реферат, курсовая, диплом, контрольная)
Волновые функции электронов в молекулах могут строиться с помощью различных математических приемов. Один из этих приемов дает результаты, достаточно хорошо совпадающие с экспериментальными данными для многих молекул, включая и такие, которые плохо поддаются пониманию на основе метода валентных связей. Сущность метода заключается в построении молекулярных орбиталей (МО) как линейных комбинаций атомных орбиталей (АО). Такой подход сокращенно обозначается как МО Л КАО. Под линейными комбинациями подразумевается сложение или вычитание волновых функций с теми или иными коэффициентами, определяемыми по соответствующим правилам.
Рассмотрим применение метода МО ЛКАО к молекуле водорода, обозначив атомы водорода Н1 и Н2 и их волновые функции у (Н1) и у (Н2). Можно составить две линейные комбинации функций для молекулярных орбиталей: 
Смысл значка * при волновой функции (2) будет пояснен ниже. Коэффициенты С для обеих атомных функций одинаковы, так как мы рассматриваем одинаковые атомы водорода. Они определяются из условия нормировки: суммарная вероятность у2 нахождения электрона во всем пространстве должна быть равна единице. При приближенном вычислении коэффициент С для функций в молекуле водорода оказывается равпым у1г
Построив молекулярные орбитали, следует вычислить соответствующую им энергию электронов на основе уравнения Шрёдингера, а далее сравнить ее с экспериментальными данными для соответствующей молекулы. Одновременно вычисляется и межатомное расстояние в молекуле. Линейная комбинация (1) приводит к значению энергии электронов более низкому, чем суммарная энергия электронов в двух отдельных атомах водорода. Поэтому молекулярная орбиталь (1) была названа связывающей МО. Для линейной комбинации (2) получается значение энергии более высокое, чем для изолированных атомов водорода. Поэтому молекулярная орбиталь (2) была названа разрыхляющей МО. Разрыхляющие орбитали принято обозначать символом Ч/*. Результаты этих расчетов приводят к следующему пониманию молекулы водорода. При сближении двух атомов водорода начинается взаимодействие электронных волн, приводящее к возникновению молекулярных орбиталей Ч' и Ч** с различными значениями энергии (рис. 6.13).

Рис. 6.13. Энергетические уровни орбиталей атомов водорода и молекулы водорода.
Конечный результат взаимодействия зависит от спиновых квантовых чисел электронов. Случай, когда спиновые квантовые числа ms противоположны, как показано на схеме, соответствует образованию устойчивой молекулы водорода. Электроны перешли на связывающую орбиталь, и энергия системы понизилась. Если бы взаимодействовали атом водорода и ион Н+, то на связывающей МО оказался бы только один электрон. Система была бы устойчива, но понижение полной энергии было бы меньше. Схема молекулярных орбиталей для водорода позволяет рассмотреть и другие варианты взаимодействия. Пусть два атома водорода имеют электроны с одним и тем же значением квантового числа ms. Тогда электроны должны будут занять разные орбитали, т. е. связывающую Ч/ и разрыхляющую Ч/* в соответствии с принципом Паули (рис. 6.14). Энергия разрыхляющей МО повышается относительно исходного уровня несколько сильнее, чем понижается энергия связывающей МО. Поэтому на любых межатомных расстояниях между атомами действует сила отталкивания, и молекула не образуется.

Рис. 6.14. При одинаковых значениях ms электронов в атомах водорода молекула не образуется Рассмотрим также возможность образования молекулы гелия с точки зрения метода МО ЛКАО. Атом гелия имеет, подобно водороду, орбитали 1л*, но их энергия понижена вследствие увеличения заряда ядра. На орбитали гелия находятся два электрона — формула 1 52 (рис. 6.15). Заселенность электронами как связывающей, так и разрыхляющей орбиталей означает, что энергия системы в целом по сравнению с изолированными атомами гелия повышается, и гипотетическая молекула Не2не обладает устойчивостью.
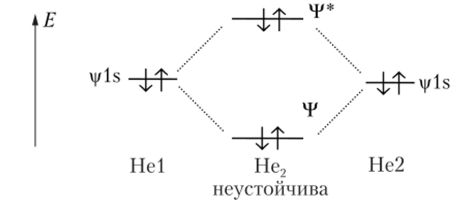
Рис. 6.15. Молекула Не2 образоваться не может, так как в ней были бы заселены как связывающая, так и разрыхляющая МО Теперь рассмотрим случай образования химической связи между атомами разных периодов. Такие атомы имеют валентные электроны на орбиталях разных уровней. Подходящим примером является образование молекулы гидрида лития LiH. Энергия электрона атома водорода на орбитали 15 ниже энергии электрона лития на орбитали 25. Литий имеет также свободные валентные орбитали 2р. Электронная пара лития 15 в образовании связи не участвует. Атомная орбиталь водорода 15 взаимодействует не только с орбиталью лития 25, но и с орбиталью 2рх, направленной от лития к водороду. Эти характеристики атомных орбиталей приводят к схеме молекулярных орбиталей для LiH, показанной на рис. 6.16.

Рис. 6.16. Молекулярные орбитали в молекуле LiH.
Прерывистыми линиями на рисунке отмечено, какие атомные орбитали дают вклад в ту или иную молекулярную орбиталь. Из пяти АО — одной орбитали водорода и четырех орбиталей лития — получается пять МО, одна из которых связывающая, две разрыхляющие и две несвязывающие (не изменяющие своей энергии по сравнению с изолированным атомом).
К несвязывающим орбиталям принадлежит и орбиталь лития 15. Связывающая орбиталь 4*5 по энергии ближе к орбитали водорода, чем к орбитали лития. Основной вклад в волновую функцию 4*5 дает орбиталь водорода, в результате чего электронное облако приближено к атому водорода. Молекула LiH оказывается полярной. На этом примере следует понять, что в случае взаимодействия атомных орбиталей разной энергии их вклад в молекулярные орбитали оказывается не одинаковым: в связывающей орбитали преобладает вклад атомной орбитали с более низкой энергией, а разрыхляющая орбиталь ближе к атомной орбитали с высокой энергией.
Рассмотрим некоторые двухатомные молекулы элементов 2-го периода таблицы Менделеева (N2, 02 и др.). Среди них наибольший интерес представляет молекула кислорода 02, непонятная, как часто говорят, в «рамках» метода валентных связей.
В молекулах Э2 с валентными орбиталями 25, 2рх, 2ру и 2р2 перекрывание двух первых орбиталей происходит по a-типу вдоль оси х, а двух следующих орбиталей — по л-типу. Обе орбитали 2ру и 2р2 имеют одинаковую энергию, в результате чего и производные от них МО имеют одинаковую энергию. Все это отражено на рис. 6.17. Эта диаграмма может быть применена ко всем молекулам Э2 элементов 2-го периода. Поэтому на ней пока не показаны электроны. У каждого атома имеются четыре валентные АО, которые преобразуются в восемь МО — четыре связывающие и четыре разрыхляющие. Эти орбитали заполняются электронами в соответствии с принципом Паули и принципом наименьшей энергии.
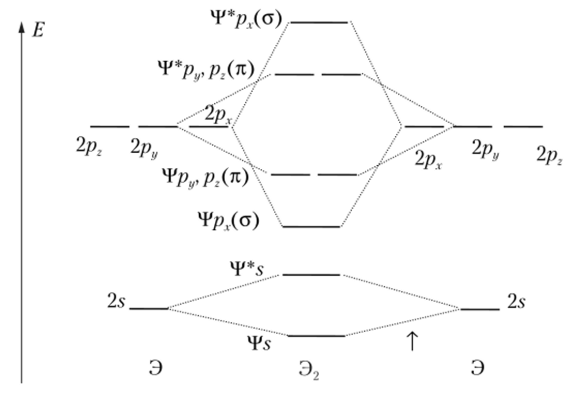
Рис. 6.17. Молекулярные орбитали в двухатомных молекулах Э2 элементов.
2-го периода Возьмем сначала молекулу азота N2. На молекулярных орбиталях потребуется разместить 10 валентных электронов двух атомов азота (рис. 6.18). Заселенными оказываются связывающая и разрыхляющая МО, происходящие от 25 атомных орбиталей. В целом они не дают эффекта связывания. Оставшиеся шесть электронов заселяют все связывающие МО — 4JpXJ соответствующую a-связи, а также 4*ру и 4Jpv соответствующие л-связям.
Таким образом, в молекуле азота имеется тройная связь. Выводы, вытекающие из рассмотрения молекулы N2 по ММО, совпадают с выводами, полученными на основе МВС:

Рис. 6.18. Размещение электронов по МО в молекуле азота.
Перейдем к молекуле следующего за азотом элемента 2-го периода — кислорода. Кислород 02 значительно более реакционноспособен, чем азот, энергия диссоциации его молекулы меньше, чем у азота. Очевидно, что молекула 02 менее прочна, чем молекула N2. Но самым необычным свойством молекулы кислорода является ее парамагнетизм, указывающий на наличие в молекуле двух неспаренных электронов. Вообще, парамагнетизм означает способность молекул втягиваться в магнитное поле. Противоположный ему диамагнетизм проявляется в выталкивании молекул из магнитного ноля. Молекулы, в которых все электроны спарены, диамагнитны. Парамагнетизм кислорода, имеющего четное число электронов, был камнем преткновения в методе валентных связей, но в методе молекулярных орбиталей это свойство получило удивительно простое объяснение. В молекуле кислорода 12 электронов, или на два электрона больше, чем в молекуле N2. Дополнительные электроны заселяют две одинаковые, но энергии разрыхляющие МО У?*ру и ЧJ*pz (рис. 6.19), причем действует правило Хунда, так как энергия орбиталей одинакова. Эти электроны придают молекуле кислорода парамагнетизм и, находясь на разрыхляющих орбиталях, понижают прочность и кратность связи. В данном случае кратность связи между атомами следует считать по следующему правилу.
Кратность связи равна половине разности общего числа электронов на связывающих и разрыхляющих МО.
Посчитаем электроны на схеме и вычислим кратность связи в молекуле 02:
8−4 0.
Кратность связи =-= 2.
1 2.
Для молекулы гелия по этой формуле получается кратность связи 0.
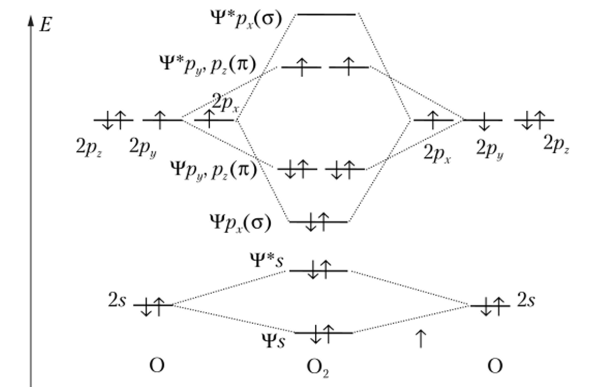
Рис. 6.19. Размещение электронов по МО в молекуле кислорода.
Рассмотрим также молекулу оксида азота (Н)и на ее примере убедимся, что кратность связи может быть дробной величиной. Набор молекулярных орбиталей молекулы NO отличается от соответствующего набора кислорода и азота лишь тем, что энергии атомных орбиталей кислорода понижены относительно азота. Они заселяются 11 валентными электронами кислорода и азота (рис. 6.20). Молекула NO имеет нечетное число электронов, вследствие чего после заселения молекулярных орбиталей электронными.
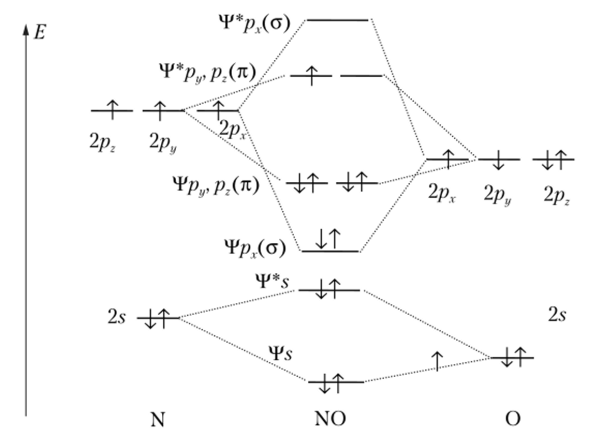
Рис. 6.20. Размещение электронов по МО в молекуле оксида азота (II) парами у нее остается один электрон для заселения разрыхляющей орбитали тг-типа. У кислорода таких электронов два, а у азота нет вообще. Поэтому кратность связи в молекуле NO промежуточная — 2,5, и соответственно этому изменяется энергия диссоциации молекул:
n2 no o2 o2
?дис, кДж/моль 941 678 494.
Длина связи, пм 110 115 121 126.
Из сравнения этих молекул, к числу которых добавлен супероксид-ион с тремя электронами на разрыхляющих орбиталях, следует, что при увеличении числа этих электронов от нуля у азота до трех у супероксид-иона последовательно уменьшается энергия диссоциации и увеличивается межатомное расстояние.
Рассмотренные примеры показывают успешное применение ММО для адекватного описания химических связей в некоторых типах двухатомных молекул. Это достигается, главным образом, благодаря использованию представления о разрыхляющих орбиталях, которые не рассматриваются в МВС.