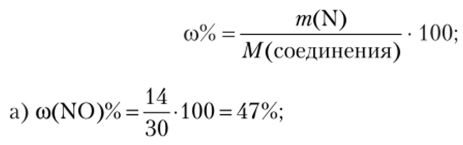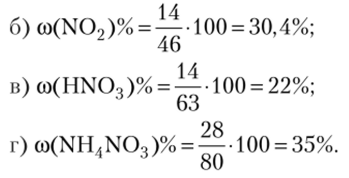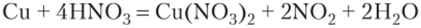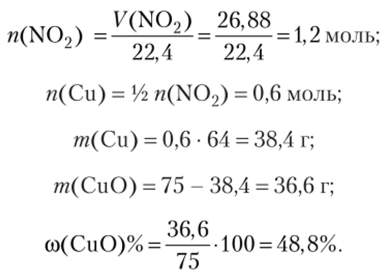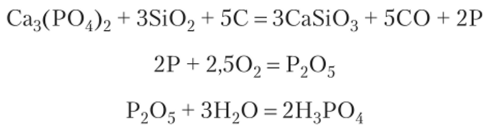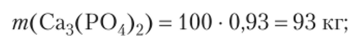Другие работы

Сегодня ученые умеют получать структуры практически всех химических элементов, что дает огромную свободу для исследований. На сегодняшний день наночастицы являются наиболее изученной областью нанохимии. Частицы металлов размером менее 10 нм, называемые кластерами, обладают высокой химической активностью и способны вступать в реакции с другими веществами практически без какой-либо дополнительной…
Реферат 
При этом A: L2 —" Ь2, а функция x (t) недифференцируема почти всюду на отрезке. Указанная ситуация может возникнуть, например, в случае, когда функция %(t) определена на траекториях винеровского процесса, которые, как известно, недифференцируемы почти всюду. При этом неограниченность обратного оператора Л-1 в данном случае обусловлена тем, что значения коэффициента %(?) не отделены от нуля…
Реферат 
Для определения итоговых затрат на запасные части очень важно учитывать все запасные части, необходимые на весь жизненный цикл газопоршневой электростанции, включая капитальный ремонт. Этот подход обусловлен тем, что предполагаемые затраты должны обеспечить бесперебойное функционирование электростанции, как до, так и после капитального ремонта. В противном случае пришлось бы покупать новую…
Реферат 
Выбираем измерительный трансформатор тока типа TG-245, установленный в первичной обмотке высшего напряжения силового трансформатора: Данный трансформатор тока типа TG-245 является термически и электродинамически стойким. Таблица 1.7 — Электрические характеристики трансформаторов тока. Где — ток электродинамической стойкости, кА. Проверяем выбранный трансформатор типа TG-245. Где — ток термической…
Реферат 
Для развития поверхности охлаждения целесообразно использовать радиаторы, навешиваемые с наружной стороны по периметру бака. Исходя из мощности, проектируемого трансформатора, будут использованы радиаторы из гнутых труб в 2 ряда. Радиаторы выпускаются стандартных размеров. В соответствии с полученными размерами трансформатора производим выбор радиаторов из таблицы 9.10. Тепловой расчет бака…
Реферат 
Однако, даже имея правильно определенные средние нормативные потери по всей городской ТС, нельзя эти данные переносить на отдельные ее участки, как это зачастую делается, например, при определении величины присоединенной тепловой нагрузки и выборе мощностей теплообменного и насосного оборудования строящегося или модернизируемого ЦТП. Необходимо их рассчитать для данного конкретного участка ТС…
Реферат 
Асинхронные двигатели с фазным ротором обычно имеют полузакрытые пазы на роторе, в которые укладывается трехфазная обмотка с тем же числом полюсов, что и обмотка статора. Предварительно изолированные стержни этой обмотки заводят с торцевой стороны ротора. Фазы роторной обмотки обычно соединяют в звезду и подводят к трем контактным кольцам, расположенным на валу двигателя и изолированным друг…
Реферат 
Одной из основных задач, решаемых с помощью эконометрических методов, является выявление и изучение взаимосвязей между признаками из некоторого заданного набора. Как указывалось в гл. 2, применение корреляционного анализа может приводить к обнаружению не только истинных, но и ложных корреляций. Напомним, что это явление связано с влиянием на значения изучаемых показателей некой третьей…
Реферат 
Вследствие довольно высокой активности, марганец легко окисляется, в особенности в порошкообразном состоянии, при нагревании кислородом, серой, галогенами. Компактный металл навоздухе устойчив, так как покрывается оксидной плёнкой (Mn2O3), которая, в свою очередь, препятствует дальнейшему окислению металла. Ещё более устойчивая плёнка образуется при действии на марганец холодной азотной кислоты…
Реферат 
Код специфический, потому что триплеты нуклеотидов (кодоны) mRNA кодируют каждый одну аминокислоту. Так как нуклеиновые кислоты состоят из комбинации четырех нуклеотидов, то существуют 64 различных триплета, кодирующих 20 аминокислот, поэтому код называется вырожденным. Например, аминокислота серин кодируется триплетами UCU, UCC, UCA, UCG, AGC. Часто при изменении третьего нуклеотида кодона…
Реферат 
В небольших двигателях мощностью менее 2…3 кВт Iм* может достигать значение 0,5…0.6, несмотря на правильно выбранные размеры и малое насыщение магнитопровода. Магнитопровод двигателя выполнен из стали 2013; толщина листов 0,5 мм. Значение намагничивающего тока находится в допустимых пределах. Так как B’z2=1,7 Тл, для выбранной стали принимаем НZ2 = 1150 А/м. Так как B’z1=1,79 Тл, для выбранной…
Реферат 
В прикладной аэрогазовой динамике получил применение метод «эффективной длины». В этом случае влияние градиента давления учитывается соответствующим подбором эффективной длины при условии равенства толщины потери энергии пограничного слоя. При известной эффективной длине характеристики пограничного слоя рассчитываются с помощью соответствующих формул для пластины. Следовательно, чтобы получить…
Реферат 
Анализируя изменение невязки уравнения (6.112) по координатех (Fo = = 0,01) (рис. 6.24), можно заметить, что максимальное значение она принимает в точке х = 1. Анализ изменения невязки уравнения (6.112) во времени в точках х = 0 и х = 1 (рис. 6.25, 6.26) показывает, что при Fo > 0,08 она становится практически равной нулю. Невязка начального условия во всем диапазоне координаты х равна нулю…
Реферат 
От выводов генератора до стены главного корпуса и далее, до главного распределительного устройства, токоведущие части выполняются пофазно-экранированным комплектным токопроводом. Выбираем по таблице ПЗ.10 ТЭНЕ-10/5000:кВ, А, кА. Выбор трансформаторов напряжения на сборных шинах Выбираем для установки на каждой секции сборных шин 10,5кВ трансформаторы напряжения трёхфазные антирезонансные…
Реферат 
Высокие концентрации ртути наблюдаются в почвах на территории вблизи ртутных месторождений, особенно находящихся над рудными телами. В почвах ртутных ореолов рассеяния содержание ртути в 2−3 раза выше фоновых значений. Большое влияние на закрепление ртути в почве оказывают органические вещества. В одном и том же элементарном ландшафте ртуть в большей степени аккумулируется в обогащенных органикой…
Реферат