Сплавы.
Общая химия

Если сплавляемые металлы не образуют химических соединений или твердого раствора, то при охлаждении расплава один из компонентов начинает выделяться в твердом виде. Если охлаждать жидкий сплав свинца и олова с массовой долей последнего 90%, то вначале выделяются кристаллы олова — совершенно так же, как при замерзании разбавленного раствора сахара в воде сначала выделяется чистый лед. Температура… Читать ещё >
Сплавы. Общая химия (реферат, курсовая, диплом, контрольная)
Металлы нерастворимы в обычных жидкостях: воде, спиртах, углеводородах, но в расплавленном состоянии могут взаимно растворяться или смешиваться друг с другом, образуя сплавы.
Большинство расплавленных металлов смешиваются в любых соотношениях, подобно тому как смешивается спирт с водой. Но некоторые металлы растворяются один в другом лишь до некоторого предела. Если смешать расплавленные цинк и свинец, то при отстаивании смеси образуются два слоя: нижний — свинец с небольшим количеством растворенного цинка и верхний — цинк, содержащий некоторое количество свинца.
При сплавлении металлов или происходит простое растворение одного металла в другом, или, что чаще, металлы вступают в химическое соединение, и поэтому сплавы обычно представляют собой смеси отдельных металлов с их химическими соединениями, образование которых нередко сопровождается значительным выделением теплоты. Например, при погружении алюминия в расплавленную медь выделяется столько теплоты, что вся масса раскаляется добела.
Многие металлы образуют по несколько различных соединений друг с другом, как, например, Аи2п, Аи:^п5, Ли2п3; Ыа4Бп, ЫаБп, ЫаБп2.
Твердые сплавы иногда совершенно однородны. В таком случае они представляют собой или определенное химическое соединение, или однородную смесь переменного состава, т. е. твердый раствор. Последний образуется, если атомы смешиваемых металлов могут замещать друг друга в кристаллической структуре, не сильно искажая ее. Большинство сплавов, однако, неоднородны и состоят из кристаллов отдельных металлов, смешанных с кристаллами химических соединений металлов, если такие соединения образуются в данной системе. Металлы сплавляются не только друг с другом, но и с некоторыми неметаллами; например, чугун и сталь представляют собой сплавы железа с углеродом.
Если сплавляемые металлы не образуют химических соединений или твердого раствора, то при охлаждении расплава один из компонентов начинает выделяться в твердом виде. Если охлаждать жидкий сплав свинца и олова с массовой долей последнего 90%, то вначале выделяются кристаллы олова — совершенно так же, как при замерзании разбавленного раствора сахара в воде сначала выделяется чистый лед. Температура, при которой начинается выделение олова, ниже, чем температура замерзания чистого олова. Определив понижение температуры замерзания сплава олова со свинцом, можно вычислить молярную массу свинца, руководствуясь законом Рауля (см. параграф 82). По понижению температуры замерзания были определены молярные массы многих металлов, и оказалось, что металлы в разбавленных металлических растворах большей частью находятся в виде отдельных атомов.
Соединения, образующиеся между металлами в сплавах, не удается выделить в индивидуальном состоянии. Поэтому для изучения химической природы сплавов приходится применять особые методы исследования, называемые физико-химическим анализом. Основателем этого направления анализа был выдающийся русский ученый Н. С. Курнаков (1860—1941).
Физико-химический анализ заключается в определении хода изменения какого-либо физического свойства системы (давления пара, температуры плавления, плотности, вязкости, электропроводности и т. п.) при постепенном изменении ее состава. Результаты измерений представляют в виде диаграмм состав — свойство. Такие диаграммы не только позволяют по виду полученных зависимостей обнаруживать происходящие в системе превращения, но и дают указания относительно характера этих превращений, состава образующихся веществ, образования твердых растворов и т. д. Физико-химический анализ используется не только в металлургии, но и в других отраслях науки и промышленности.
Одно из важнейших направлений физико-химического анализа — термический анализ. Изучаются зависимости температур плавления сплавов от содержания компонентов. Остывание чистого расплавленного металла и сплава происходит по-разному. На рис. 25.7 представлена зависимость температуры от времени для чистого висмута (а) и его сплава, содержащего 20% кадмия (б). На участке а к температура висмута плавно понижается. При 271 °C металл начинает затвердевать, выделяется теплота кристаллизации, и температура остается постоянной до затвердевания всего металла (отрезок к — с). После этого охлаждается твердый висмут, и температура плавно падает до температуры окружающей среды. Сплав В — Сс1 сначала охлаждается так же, как металл, но при 194 °C обнаруживается излом линии, остывание замедляется. Анализ явления показывает, что при этой температуре начинается выделение кристаллов висмута, состав расплава изменяется (подобно замерзанию разбавленных растворов), и температура его кристаллизации понижается. При температуре 140 °C падение температуры приостанавливается. Происходит затвердевание расплава с одновременным выделением кристаллов висмута и кадмия, без изменения состава жидкой фазы. В точке с расплав полностью затвердел, и на участке с — Ь охлаждается твердый сплав. На основе кривых охлаждения при разных составах расплава от 100% одного металла до 100% второго металла строится диаграмма плавкости, показывающая поведение соответствующей системы.
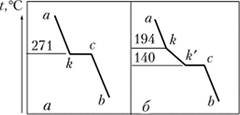
Рис. 25.7. Кривые охлаждения:
а — расплавленный висмут; б — сплав В4 — С4.
Рассмотрим диаграмму плавкости системы В' — Сс1 (рис. 25.8), типичную для многих металлических систем. Она характеризуется наличием эвтектики, т. е. такого состава сплава, который плавится или затвердевает при некоторой минимальной температуре, более низкой, чем температуры плавления каждого из металлов. На рисунке по горизонтальной оси отложено содержание кадмия от 0% (это чистый висмут) до 100% (чистый кадмий). Содержание висмута в каждой точке координат будет разностью между 100% и содержанием кадмия. При изменении исходного состава от чистого кадмия в сторону увеличения доли висмута температура затвердевания уменьшается от точки затвердевания (плавления) кадмия 321 °C до минимальной температуры 140 °C, которая и является температурой эвтектики с долей кадмия 40% и соответственно долей висмута 60%. При изменении состава сплава от чистого висмута в сторону увеличения доли кадмия температура затвердевания уменьшается от точки затвердевания (плавления) висмута 271 °C до той же температуры эвтектики.
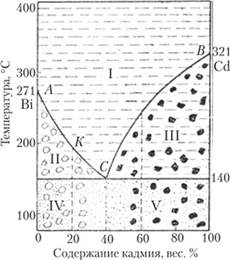
Рис. 25.8. Диаграмма плавкости системы висмут — кадмий.
Диаграмма распадается на пять полей, ограниченных кривыми затвердевания АС и ВС, горизонталью при 140 °C и вертикалью при 40% кадмия (состав эвтектики). Каждое поле имеет определенный физический смысл. Поле I, расположенное выше кривых затвердевания, соответствует условиям существования только расплавленной смеси металлов. При температуре и составе, соответствующих полю И. одновременно существуют кристаллы висмута и расплав. Состав этого расплава отличается от исходного состава смеси, так как некоторая часть висмута переходит в твердую фазу. Все то же самое относится к полю III, но здесь присутствуют кристаллы кадмия. Поле IV соответствует затвердевшей эвтектической смеси, в которой присутствуют более крупные кристаллы успевшего выделиться висмута. Аналогичный смысл имеет поле V — эго твердая эвтектика, в которую вкраплены более крупные кристаллы кадмия. Эти два поля можно продлить в сторону более низких температур, чем показано на диаграмме. При исходном составе расплава, соответствующем эвтектике, весь сплав как один компонент при 140 °C затвердевает в эвтектику, состоящую из тесно перемешанных мелких кристаллов обоих металлов.
Эвтектические смеси образуют также медь и серебро, свинец и сурьма и многие другие металлы. Изучив диаграмму плавкости, можно выбирать состав, соответствующий определенной структуре твердого сплава и температуре плавления.
Более сложный вид имеют диаграммы плавкости в тех случаях, когда два металла при сплавлении образуют одно или несколько химических соединений. Рассмотрим диаграмму плавкости системы магний — свинец (рис. 25.9). На диаграмме обнаруживается максимум температуры плавления при составе 19% магния и 81% свинца.
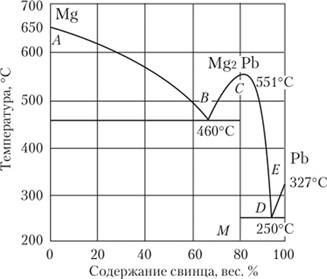
Рис. 25.9. Диаграмма плавкости системы магний — свинец.
Рассчитаем молярное соотношение магния и свинца в этом сплаве (табл. 25.2).
Таблица 25.2
Молярное соотношение магния и свинца в сплаве Мй2РЬ.
Свойства. | Элементы. | |
магний. | свинец. | |
М, г/моль. | 24,3. | 207,2. |
т, г. | ||
п, моль. | 0,782. | 0,391. |
Результат расчета означает, что в системе образуется соединение Mg2Pb с температурой плавления 551 °C. Левая часть диаграммы соответствует сплавам магния с соединением Mg2Pb. В этом сплаве есть эвтектика с ^ = = 460 °C. Правая часть диаграммы — это сплавы соединения Mg2Pb со свинцом. Здесь также есть эвтектика с ?пл = 250 °C.
Пример 25.2. Рассчитайте массовые доли магния и Мй2РЬ в эвтектическом сплаве, используя диаграмму плавкости, приведенную на рис. 25.9.
Решение. По диаграмме можно определить массовую долю свинца в эвтектике — 63,5%. Весь этот свинец связан в соединении М#2РЬ. Рассчитаем на 100 г сплава количество вещества металлов //, количество вещества металлов, связанных в соединении, п2 и количество вещества избыточного магния п, а также его массу (табл. 25.3).
Таблица 253
Расчет для примера 25.2.
Свойства. | Элементы. | Сплав Мя2рь. | |
магний. | свинец. | ||
Л/, г/моль. | 24,3. | 207.2. | 255,8. |
т, г. | 36,5. | 63.5. | |
/Ц, моль. | 1,502. | 0,3065. | |
п2, моль. | 2 0,3065. | 0,3065. | 0.3065. |
п, моль. | 0,889. | ||
т, г (избыток). | 21,6. | 78.4. | |
Из данных табл. 25.3 следует, что эвтектика содержит 21,6% магния, а остальные 78,4% — соединение Мй2РЬ.
На примере системы магний — свинец мы видим, что физико-химический анализ позволяет обнаружить соединения, образующиеся между металлами, т. е. интерметаллические соединения. Больше всего таких соединений образуют металлы 5-блока с металлами р-блока. К числу этих соединений относится ^2РЬ.
Близкие по физико-химическим свойствам металлы могут обладать неограниченной взаимной растворимостью как в жидком, так и в твердом состоянии. В этом случае сплав не является совокупностью сросшихся кристаллических зерен двух металлов, а состоит из однотипных кристаллов, в которых часть атомов одного металла замещена атомами другого металла. Системой такого типа является сплав золота и серебра. Диаграмма плавкости представляет собой плавную кривую, идущую от точки плавления серебра до точки плавления золота при соответствующем изменении массовых долей металлов (рис. 25.10). При остывании расплава некоторого состава (точка Л) до перехода в точку Л' на кривой затвердевания, называемой также линией ликвидуса, расплав начинает затвердевать. Из него выделяется твердый раствор, состав которого соответствует точке Л" . Очевидно, что выделяющиеся кристаллы твердого раствора несколько обогащены более тугоплавким компонентом. В результате этого по мере затвердевания расплава состав твердого раствора постепенно изменяется. Совокупность точек, соответствующих составу твердого раствора в процессе затвердевания, называется линией солидуса.

Рис. 25.10. Диаграмма плавкости системы серебро — золото На приведенных диаграммах (рис. 25.7—25.10) рассмотрены простейшие примеры систем, показывающие различные явления в металлических сплавах. Реально образуются и исследуются в металловедении весьма сложные системы, часто состоящие из трех и более компонентов.