Гидролиз солей.
Аналитическая химия в 2 книгах.
Книга 1. Химические методы анализа

От явлений сольватации и гидратации следует отличать процессы сольволиза и гидролиза, при которых молекулы растворителя (например, воды), взаимодействуя с ионами растворенного вещества, распадаются на составные части (ионы), вступающие в реакцию с ионами растворенного вещества. Пример реакции гидролиза — взаимодействие с водой тех же катионов Ni2+ в водном растворе: Исследования продуктов… Читать ещё >
Гидролиз солей. Аналитическая химия в 2 книгах. Книга 1. Химические методы анализа (реферат, курсовая, диплом, контрольная)
Ионы растворенного вещества могут по-разному взаимодействовать с молекулами растворителя (сольвента). Если при взаимодействии ионов растворенного вещества с молекулами растворителя ионы окружаются нейтральными молекулами растворителя с образованием солъватокомплекса, то такое явление называется сольватацией, для водных растворов — гидратацией. Типичный процесс гидратации — образование аквакомплексов [Ме (Н20)т]п+ в водных растворах, в которых содержатся катионы металла Меп+:

Например, может образоваться аквакомплекс Ni2+:

От явлений сольватации и гидратации следует отличать процессы сольволиза и гидролиза, при которых молекулы растворителя (например, воды), взаимодействуя с ионами растворенного вещества, распадаются на составные части (ионы), вступающие в реакцию с ионами растворенного вещества. Пример реакции гидролиза — взаимодействие с водой тех же катионов Ni2+ в водном растворе:
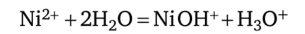
В этой схеме для краткости не указаны молекулы воды гидратной оболочки катиона Ni2+.
Таким образом, солъволиз — это процесс взаимодействия растворенного вещества с ионами, образующимися при ионизации молекул растворителя. Частный случай сольволиза — гидролиз.
Гидролиз — взаимодействие ионов растворенной соли с протонами (катионами водорода) или гидроксидными группами молекул воды. Дословно гидролиз означает «разложение водой».
Гидролизу в водных растворах подвергаются соли, содержащие катионы слабых оснований и анионы слабых кислот. Соли, содержащие катионы сильных оснований и анионы сильных кислот, в водных растворах практически не гидролизуются. Следовательно, справедливо и такое определение: гидролиз солей — взаимодействие ионов соли с водой, приводящее к образованию слабого электролита (кислоты или основания).
Поскольку при этом ионы соли взаимодействуют с ионами Н+ или ОНводы, гидролиз сопровождается изменением pH раствора. Это происходит, когда равновесие диссоциации воды смещается в результате получения малодиссоциирующих электролитов.
Гидролиз солей многоосновных слабых кислот или многокислотных слабых оснований происходит по ступеням. Известны три варианта гидролиза солей.
1. Гидролиз солей, образованных сильным основанием и слабой кислотой (например, Na2C03, K2S, CH3COONa), — это гидролиз по аниону, поскольку только анионы этих солей связывают протоны, образуя слабые электролиты.
Так, первая ступень гидролиза карбоната натрия в сокращенной молекулярно-ионной форме описывается схемой.

В полной молекулярно-ионной форме.

В молекулярной форме.

В данном примере анионы СО§_ взаимодействуют с протонами (катионами водорода) воды, при этом получаются анионы НС03, равновесие диссоциации воды смещается, в растворе накапливаются анионы ОН-, раствор Na2C03 приобретает щелочную реакцию (pH > 7).
Вторую ступень гидролиза можно описать одним из следующих уравнений:

Образуется слабая кислота — угольная, накапливаются ионы ОН~.
(рН > 7).
Вторая ступень гидролиза солей всегда выражена слабее, гидролиз протекает главным образом по первой ступени.
2. Гидролиз солей, образованных слабым основанием и сильной кислотой (например, NH4C1, CuS04, ZnCl2), — это гидролиз по катиону, так как только катионы этих солей связывают ОН-ионы воды, образуя малодиссоциирующие основания. При этом если соль образована многокислотным основанием, гидролиз протекает по ступеням. Первая ступень гидролиза хлорида цинка в сокращенной молекулярно-ионной форме:

В полной молекулярно-ионной форме.

В молекулярной форме.

Катионы Zn2+ связывают ОН-ионы воды с образованием малодиссоциирующих катионов ZnOH+, равновесие диссоциации воды смещается, в растворе накапливаются катионы Н+ (pH < 7).
По второй ступени гидролизуется хлорид гидроксоцинка:

В молекулярной форме.

Вследствие накопления катионов Н+ раствор приобретает кислую реакцию.
3. Гидролиз солей, образованных слабым основанием и слабой кислотой (например, CH3COONH4, (NH4)2S, A12S3), происходит по катиону и аниону. Продукты гидролиза таких солей — слабые кислоты и слабые основания, одновременно связываются катионы Н+ и анионы ОН- воды.
Например, уравнение гидролиза ацетата аммония:

В молекулярной форме.

Такие соли подвергаются гидролизу полностью: 
Поэтому сульфид алюминия в водном растворе не существует.
Количественно гидролиз солей характеризуют степенью гидролиза — отношением концентрации гидролизованной части соли к общей концентрации ее в растворе (аг, %):

где сг — концентрация гидролизованной соли, моль/л; с — исходная концентрация растворенной соли, моль/л.
Степень гидролиза соли тем выше, чем слабее кислота или основание, образующие эту соль. Например, в 0,1 М растворе сульфида аммония степень гидролиза 100%; это выше, чем в 0,1 М растворе карбоната аммония (86%). Это объясняется тем, что константа диссоциации сероводородной кислоты по второй ступени К2(HS-) = 1,3 • lO13, что значительно меньше константы диссоциации угольной кислоты по второй ступени К2(НСОз) = 5,6110_11.
Гидролиз солей — обратимый процесс, он характеризуется константой гидролиза Кт, представляющей собой константу равновесия гидролитической реакции.
Рассмотрим состояния равновесия гидролиза соли, образованной сильным основанием и слабой кислотой, например цианида калия:

Константа равновесия этой реакции.

Поскольку концентрация воды практически остается постоянной, то произведение константы равновесия К и концентрации воды [Н20] образует постоянную, называемую константой гидролиза:

Из уравнения диссоциации слабой циановодородной кислоты HCNH+ +CN- на основании закона действующих масс следует, что константа кислотности Кк равна.

откуда.

Вводим уравнение (4.38) в уравнение (4.36) и получаем.

После сокращения [CN~] и с учетом [ОН-] [Н+] = Кв уравнение (4.39) принимает вид.

Таким образом, константа гидролиза щелочной соли (т. е. соли, образованной сильным основанием и слабой кислотой) представляет собой отношение ионного произведения воды к константе диссоциации слабой кислоты, образующейся при гидролизе.
Пример 1.
Вычислите константу гидролиза цианида калия в растворе.
Решение. Константа диссоциации циановодородной кислоты Кк = 7,2 • 10-10, Ко 10-14
следовательно, Кг ——— =-—? = 1,4−10~5.
Кк 7,2−10_1°.
Ответ: константа гидролиза цианида калия Кг= 1,4 • 10-5.
Аналогичный вывод формулы для расчета константы гидролиза можно сделать и для солей, образованных слабым основанием и сильной кислотой. При этом константа гидролиза равна отношению ионного произведения воды к константе диссоциации основания:

где К0 — константа диссоциации слабого основания, образующегося при гидролизе соли.
Следовательно, константа гидролиза соли, образованной слабым основанием и сильной кислотой, представляет собой отношение ионного произведения воды к константе диссоциации слабого основания, получающегося при гидролизе.
Пример 2.
Вычислите константу гидролиза хлорида аммония, гидролизующегося с образованием аммиака.
Решение. В приложении А, 5А приведена константа диссоциации в растворе аммиака iC (NH3-H20) = 1,79 • ICh5. Следовательно:

Ответ: константа гидролиза хлорида аммония Кг = 5,6 • 10~10
Константы гидролиза солей, образованных слабым основанием и слабой кислотой, вычисляют по уравнению.

где К0 и Кк — соответственно константы диссоциации слабого основания и слабой кислоты, образующихся в результате гидролиза соли.
Константа гидролиза соли, образованной слабым основанием и слабой кислотой, представляет собой отношение ионного произведения воды к произведению констант диссоциации слабого основания и слабой кислоты, получающихся при гидролизе.
Пример 3.
Вычислите константу гидролиза ацетата аммония, гидролизующегося с образованием уксусной кислоты и аммиака.
Решение. Кк(СН3СООН) = 1,86 • 10-5 и iCB(NH3 • Н20) = 1,79 • Kh5 (см. приложение А, 5А).
Поэтому Кг = КЬ/ (KJQ = 10-14: (1,79 • НУ5 • 1,86 • НУ5) = 3 • lCh5. Ответ: константа гидролиза ацетата аммония Кг = 3 • ICh5.
Между степенью и константой гидролиза имеется взаимосвязь. Например, для соли, образованной слабым основанием и слабой кислотой, эта взаимосвязь имеет вид.

Следовательно, степень гидролиза соли, образованной слабым основанием и слабой кислотой, пропорциональна корню квадратному из константы гидролиза.
Пример 4.
Вычислите степень гидролиза ацетата аммония.
Решение. K0(NH3 • Н20) = 1,79 • 10~5, Кк(СН3СООН) = 1,86 • 10-5, следовательно,.

В процентах это составляет: 5,3 • 10-3 • 100 = 0,53%. Ответ: аг — 0,53%.
Вычисление pH гидролизующихся солей. Выведем уравнение для вычисления pH соли, образованной сильным основанием и слабой кислотой, например ацетата натрия: 
Поскольку при гидролизе ацетата натрия образуется равное количество молекул кислоты и ионов ОН-, т. е. [СН3СООН] = [ОН-], уравнение константы гидролиза для этой соли имеет вид.

Концентрацию ацетат-ионов можно принять равной исходной концентрации соли сс. Тогда уравнение (4.44) примет вид.

Концентрацию гидроксид-ионов находят из уравнения ионного произведения воды:

Вводим выражение (4.46) в уравнение (4.45) и получаем.

Логарифмируя уравнение (4.47) и меняя знаки, получаем уравнение для вычисления pH щелочной соли:

или, учитывая, что Кк = Ю-14 иlgКк = рКк (при 298 К), находим 
Пример Вычислите pH 0,1 М раствора CH3COONa.
/Ск(СН3СООН) = 1,86 • 10-5; с = 0,1 моль/л. Вводя эти данные в формулу (4.48), получаем: 
Аналогично выводится уравнение для вычисления pH растворов солей, образованных слабым основанием и сильной кислотой; при этом учитывается константа диссоциации слабого основания К0:

где рК0 — отрицательный логарифм константы диссоциации слабого основания; сс — концентрация соли, моль/л.
Для солей, образованных слабой одноосновной кислотой и слабым основанием, pH вычисляют по уравнению.

где рКк — отрицательный десятичный логарифм константы диссоциации слабой кислоты; рКа — отрицательный десятичный логарифм константы диссоциации слабого основания.
Пример Вычислите pH раствора ацетата аммония.
Решение. Вычислим pH раствора по уравнению (4.50): 
Гидролиз в соответствии с протолитической теорией — это реакция между кислотой или основанием и молекулами воды. Например, ацетат-ион — акцептор протона — взаимодействует с водой, как с кислотой:

Катион аммония NH^ — донор протона — реагирует с водой, как с основанием:

По представлениям Й. Бренстеда, гидролиз — не особый процесс в водных растворах, а обычная реакция перехода протона от кислоты к основанию, так как вода может проявлять свойства и кислоты, и основания.
Исследования продуктов гидролиза показали, что в водных растворах солей присутствуют комплексные соединения. Гидролиз солей связан с образованием гидратной оболочки иона. Например, гидролиз соли алюминия происходит по стадиям. Сначала соль диссоциирует на ионы:

Катион А13+ гидратируется с получением аквакомплекса:

В гидратной оболочке одна из молекул воды теряет протон, обусловливающий кислую среду раствора: 
протон переходит в ион гидроксония:

В целом равновесие гидролиза соли алюминия можно описать схемой.

т. е. гидратированные катионы алюминия связывают гидроксид-ионы воды, причем происходит перестройка внутренней сферы комплекса.
Однако этим изменение гидратированного иона не ограничивается. Образовавшийся ион теряет второй протон:

возможна также потеря третьего протона:

который также переходит в ион гидроксония. Но растворимость гидроксида алюминия мала, он осаждается:

и равновесие сдвигается вправо.
Аналогично гидролизуются соли Cr3+, Fe3+ и некоторых других металлов.
В аналитической практике гидролиз солей часто мешает выполнению аналитических реакций и его приходится подавлять. Например, при осаждении катионов Са2+, Sr2+ и Ва2+ карбонатом аммония для подавления гидролиза этого реагента прибавляют раствор аммиака:

При осаждении Fe2+, Fe3+, Zn2+, Мп2+ действием сульфида аммония (NH4)2S также необходимо для подавления гидролиза добавлять NH3-H20:

Гидроксиды, образуемые этими катионами, являются слабыми основаниями, и соли их сильно гидролизуются. Наиболее распространены соли сильных кислот (НС1, HN03, H2S04). Растворы таких солей имеют кислую реакцию, и поэтому перед осаждением катионов их нейтрализуют. Соли, образованные некоторыми катионами и слабыми кислотами (H2S, Н2С03 и др.), гидролизуются так сильно, что практически в водных растворах не существуют. Например, хотя большинство катионов третьей группы осаждается сульфидом аммония (NH4)2S в виде сульфидов, ионы Сг3+ и А13+ осаждаются в виде гидроксидов Сг (ОН)3 и А1(ОН)3. Это происходит потому, что концентрация ионов ОН-, образующихся в растворе при гидролизе (NH4)2S, достаточна, чтобы произведения растворимости Сг (ОН)3 и А1(ОН)3 были превышены и гидроксиды выпали в осадок. Для других катионов это не наблюдается, так как их гидроксиды более растворимы, чем сульфиды.
Если введение в раствор продуктов, получающихся при гидролизе, подавляет гидролиз, то связывание одного из продуктов в слабый электролит, наоборот, усиливает гидролиз.
Гидролиз солей учитывают и при выполнении ряда других аналитических операций. Так, в ходе анализа смеси катионов Na+, К+, NH4, Mg2+ после выпаривания раствора удаляют осадок основного хлорида магния MgOHCl, образующегося в результате гидролиза соли магния:

В ходе анализа ионы А13+ и Fe3+ удаляют из раствора действием ацетата натрия NaCH3COO. При этом в осадок выпадают не средние, а основные соли, также образующиеся в результате гидролиза ацетатов:

Таким образом, не всегда гидролиз солей препятствует выполнению аналитических операций. Нередко его применяют для обнаружения или отделения ионов.