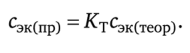Способы выражения концентрации в титриметрическом анализе.
Типовые расчеты

Единица измерения молярной концентрации эквивалентов — моль/м3, или моль/л, сокращенное обозначение — «н.» (старое название молярной концентрации эквивалентов — «нормальность», «нормальная концентрация» — применять не рекомендуется). Титр раствора по определяемому веществу X, или титриметрический фактор пересчета, — масса титруемого (анализируемого) вещества X, взаимодействующего с 1 мл титранта… Читать ещё >
Способы выражения концентрации в титриметрическом анализе. Типовые расчеты (реферат, курсовая, диплом, контрольная)
В титриметрическом анализе наибольшее применение имеют следующие способы выражения концентрации растворов: молярная концентрация св, молярная концентрация эквивалентов сэк(В), а также титр растворенного вещества Тв, подробно рассмотренные в гл. 1.
Титр растворенного вещества Тв — масса растворенного вещества (В), содержащегося в 1 мл (1 см3) раствора:

где тв— масса растворенного вещества, г; Vp— объем раствора, мл. Титр измеряется в г/мл (в некоторых случаях — мг/мл или мкг/мл). Молярная концентрация св — количество растворенного вещества В, содержащегося в 1 л раствора:

где пв — количество вещества, моль; тв — масса растворенного вещества, г; Мв — молярная масса растворенного вещества, г/моль; Vp — объем раствора, л.
Единица измерения молярной концентрации — моль/м3, или моль/л. В практике широко используют сокращенную форму записи молярной концентрации М: 0,1 М — децимолярный раствор; 0,05 М — пятисантимолярный; 1 М — одномолярный и т. д.
Зная титр растворенного вещества Тв, можно рассчитать молярную концентрацию:

Концентрация растворов в титриметрическом анализе рассчитывается до четырех значащих цифр.
Пример Титр раствора хлороводородной кислоты равен 0,2 302 г/мл; М (НС1) = = 36,5 г/моль. Молярная концентрация ее равна: 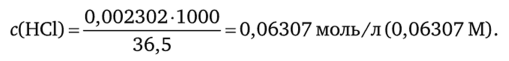
Молярная концентрация эквивалентов сэк(В) — количество эквивалентов растворенного вещества В, содержащегося в 1 л раствора:

где тв — масса растворенного вещества, г; МЭК(В) — молярная масса эквивалентов растворенного вещества, г/моль; Vp — объем раствора, л.
Молярная концентрация эквивалентов (сэк) связана с титром растворенного вещества соотношением.

Пример Навеску карбоната натрия Na2C03 0,5312 г растворили в мерной колбе вместимостью 100 мл. Молярную концентрацию эквивалентов этого раствора рассчитывают следующим образом:
- 1) вычисляют титр раствора: TNa2Co3 =0,5312/100 = 0,5 312 г /мл;
- 2) находят молярную массу эквивалентов соли (см. гл. 1).

M (Na2C03) = 106 г/моль; z3K— эквивалентное число, z (Na2C03) = 2 (см. гл. 1). M3K(Na2C03) = 106: 2 = 53 г/моль;
3) рассчитывают молярную концентрацию эквивалентов карбоната натрия: c3K(Na2C03) = (0,5 312 • 1000): 53 = 0,1002 моль/л.
Единица измерения молярной концентрации эквивалентов — моль/м3, или моль/л, сокращенное обозначение — «н.» (старое название молярной концентрации эквивалентов — «нормальность», «нормальная концентрация» — применять не рекомендуется).
Обозначение c3K(Na2C03, Н20, z = 2) = 0,1 н. отвечает децимолярному водному раствору Na2C03, содержащему в 1 л 0,1 моль эквивалентов Na2C03 или в г: M3K(Na2C03) • 0,1 =53 • 0,1 =5,3 г.
Титр раствора по определяемому веществу X, или титриметрический фактор пересчета, — масса титруемого (анализируемого) вещества X, взаимодействующего с 1 мл титранта Т. Измеряется, как и титр раствора, в г/мл, символ — Г(т/Х).
Титр раствора по определяемому веществу — величина, равная отношению произведения титра титранта на молярную массу эквивалентов определяемого вещества к молярной массе эквивалентов титранта:

где Г(т/Х) — титр титранта по определяемому веществу, г/мл; Тт — титр титранта, г/мл; МЗК(Х) — молярная масса эквивалентов определяемого вещества, г/моль; Мэк(Т) — молярная масса эквивалентов титранта, г/моль.
^ МЭК(Х) ,.
Отношение ——-называют титриметрическим множителем (фак;
Мэк (Т) тором пересчета в титриметрии — FT).
Нитрат серебра — титрант в аргентометрическом титровании TAgN03 = = 0,1 699 г/мл. Найти титр нитрата серебра по хлорид-иону T(AgN03/cl_).
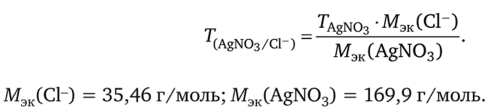
Следовательно, 7(AgN03/ci-) = (0,1 699 • 35,46): 169,9 = 0,3 546 г/мл.
Таким образом, 1 мл серебра с титром 0,1 699 г/мл оттитровывает 0,3 546 г хлорид-ионов.
Зная титр по определяемому веществу и объем титранта, израсходованный на титрование, можно рассчитать массу анализируемого вещества X в растворе.
Например, если на титрование 20 мл раствора, содержащего хлорид-ионы, израсходовано 20,45 мл нитрата серебра с титром по хлорид-иону 0,3 546 г/мл, то в анализируемом растворе содержалось хлорид-ионов:
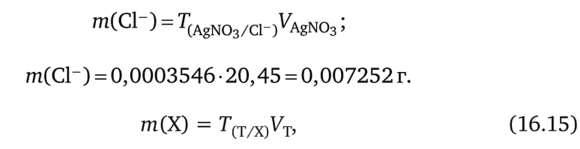
где т (Х) — масса анализируемого вещества в титруемом растворе, г; Т (Т/х) — титр титранта по определяемому веществу, г/мл; Ут— объем титранта, израсходованный на титрование анализируемого раствора, мл.
Если для титрования была взята аликвота, т. е. часть раствора, тогда необходимо в формулу (16.14) ввести множитель, который равен отношению общего объема анализируемого раствора V0 к объему аликвоты, взятой для титрования:
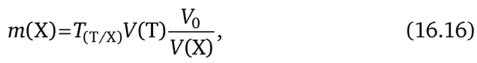
где Т (Т/Х) — титр титранта по определяемому веществу, г/мл; V (T) — объем титранта, израсходованный на титрование аликвоты (Ух) анализируемого раствора, мл; V0 — общий объем анализируемого раствора, мл; У (Х) — объем анализируемого раствора, взятый для титрования, мл.
Например, общий объем раствора, анализируемого на содержание хлорид-ионов, равен 1 л (У0 = 1 л = 1000 мл).
Аликвота анализируемого раствора равна 20 мл (У (Х) = 20 мл).
Титр нитрата серебра по хлорид-иону равен 0,3 546 г/мл — Т’сг/х);
Объем нитрата серебра, израсходованный на титрование 20 мл анализируемого раствора, равен 20,45 мл — V (T).
Находим массу хлорид-ионов в 1 л анализируемого раствора по формуле (16.16):
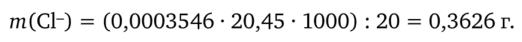
В 1 л анализируемого раствора содержится 0,3626 г хлорид-ионов.
Поправочный коэффициент титранта Кт — число, выражающее отношение действительной (практической) концентрации вещества в растворе к его заданной (теоретической) концентрации:

Пусть, например, требуется приготовить раствор с заданной (теоретической) концентрацией 0,1000 моль/л. Практически приготовлен раствор с концентрацией 0,1056 моль/л. Поправочный коэффициент Кт = 0,1056: 0,1000 = 1,056.
В дальнейшем при применении приготовленного раствора можно во всех расчетах использовать теоретическую концентрацию, вводя поправочный коэффициент: