Уравнение состояния идеального газа

Полученные в этом разделе уравнения справедливы только в том случае, когда молекулы не взаимодействуют друг с другом. Поэтому эти уравнения правильно описывают состояния реальных газов только при условии, что энергия взаимодействия молекул мала по сравнению с их средней кинетической энергией. Это условие выполняется только при достаточно низких значениях концентрации молекул, когда среднее… Читать ещё >
Уравнение состояния идеального газа (реферат, курсовая, диплом, контрольная)
Зависимость давления от температуры и объема для идеального газа можно установить следующим образом. Когда газ находится в состоянии термодинамического равновесия, которое, как было установлено, описывается функцией Максвелла — Больцмана (3.27), среднее значение квадрата скорости молекулы определяется формулой (3.43). Подстановка этой формулы в выражение (3.22) для давления газа приводит к уравнению Так как газ находится в равновесном состоянии, его температура во всех точках занимаемого им объема одинакова. Однако концентрация молекул, как это видно из формулы (3.29), в общем случае является функцией от координат. Поэтому и давление газа согласно формуле (4.8) может изменяться от одной точки пространства к другой.
В том случае, когда внешнее силовое поле отсутствует, молекулы газа будут равномерно распределены по объему. При этом их концентрация будет всюду одинакова и равна отношению числа молекул N к объему газа V:
Подстановка отношения (4.9) в уравнение (4.8) приводит к уравнению состояния.


Важно отметить, что уравнения (4.8) и (4.10) справедливы как для чистого газа, состоящего из одинаковых молекул, так и для смеси различных газов. Покажем, что это в самом деле так и есть. Число частиц в газовой смеси равно сумме чисел молекул, входящих в состав каждого из газов: 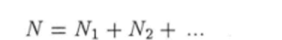
Разделив это равенство на объем V, получим:
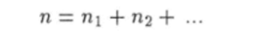
т.е. концентрация молекул в газовой смеси равна сумме концентраций чистых газов.
Давление, создаваемое молекулами одного газа,.
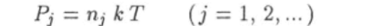
называется парциальным давлениьм. Так как давление есть сила, отнесенная к площади поверхности, на которую она действует, давление в смеси газов равно сумме парциальных давлений:

Это утверждение называется законом Дальтона (Джон Дальтон (1766 — 1844) — английский химик и физик). Нетрудно видеть, что этот закон приводит к уравнению (4.8).
При помощи соотношения (4.7) выразим число молекул через число мелей:

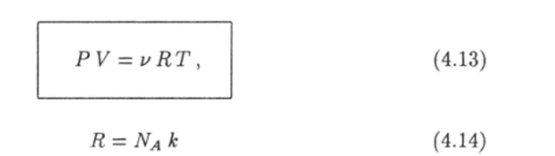
Подставив это выражение в равенство (4.10), получим уравнение Клапейрона — Менделеева (Бенуа Клапейрон (1799 — 1864) — французский физик) где.
— так называемая универсальная газовая постоянная, численное значение которой 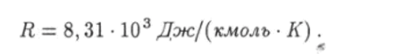
Полученные в этом разделе уравнения справедливы только в том случае, когда молекулы не взаимодействуют друг с другом. Поэтому эти уравнения правильно описывают состояния реальных газов только при условии, что энергия взаимодействия молекул мала по сравнению с их средней кинетической энергией. Это условие выполняется только при достаточно низких значениях концентрации молекул, когда среднее расстояние / = 1 /у/п между молекулами достаточно велико.
Простая форма уравнения состояния идеального газа делает удобным его использование в качестве термометрического тела. Термометр, показания которого пропорциональны давлению идеального газа при постоянном объеме, обладает в силу равенства (4.13) идеально линейной температурной шкалой. Такая шкала называется идеальной газовой шкалой температур. По международному соглашению в качестве термометрического тела решено использовать водород. Установленная при помощи водородного термометра шкала называется эмпирической шкалой температур.