Жидкие растворы.
Общая и неорганическая химия

Если растворитель и растворяемое вещество находятся в разных по природе фазах, то растворимость всегда ограничена некоторым пределом. В разных системах этот предел различен. Например, предельное содержание кислорода в водном растворе невелико, диоксида углерода — больше, хлороводорода — еще больше. При комнатной температуре в стакане воды невозможно растворить столовую ложку поваренной соли… Читать ещё >
Жидкие растворы. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
В нашей обыденной жизни термин «раствор» ассоциируется исключительно с жидкой системой, несмотря на то, что и с другими типами растворов мы имеем дело практически всегда. Воздух, которым мы дышим, — это газовый раствор, большинство металлических предметов, которыми мы пользуемся, в частности медные и так называемые серебряные монеты, — это твердые растворы.
И все-таки жидкие растворы играют в нашей жизни, в промышленности, в науке исключительную роль. В виде водных растворов живые организмы получают необходимые неорганические вещества, в виде растворов выводятся из организма ненужные продукты.
Производство минеральных удобрений, соды, искусственных волокон, красителей связано с переработкой громадных объемов водных и неводных растворов. Именно здесь возникают серьезные экологические проблемы, связанные с очисткой сточных вод, в частности удаление из них растворенных веществ.
Широкое использование жидких, особенно водных растворов, обусловлено высокой технологичностью жидких систем — с ними проще, удобнее, экономически выгоднее работать, чем с другими.
Занимая промежуточное положение между твердыми телами и газами, жидкости способны растворять в себе и те и другие. Рассматривая свойства жидких растворов, мы будем обсуждать их сходство и различие с растворами других типов.
Раствором называется гомогенная система, образованная двумя или более веществами, которые, как правило, подразделяют на растворитель и растворенные вещества.
Растворителем называют то вещество, которое в чистом виде находится в такой же фазе, что и раствор. В случае твердых растворов — это твердые вещества, в случае жидких растворов — жидкости. Если одна жидкость растворяется в другой, то растворителем обычно считается та, которой в растворе больше. Если вода является одним из веществ раствора, то, как правило, ее считают растворителем.
Способность вещества переходить в раствор называется растворимостью. Растворимость может быть неограниченной или ограниченной. Неограниченная взаимная растворимость встречается только в таких системах, в которых и растворитель и растворенное вещество находятся в одинаковых фазах. Например, при обычных условиях все газы взаимно неограниченно растворимы. Взаимно неограниченно растворимы серная кислота и вода, некоторые металлы, все жидкие углеводороды. Но такие жидкости, как вода и керосин, взаимно почти нерастворимы, а вода и диэтил овый эфир растворимы друг в друге ограниченно.
Если растворитель и растворяемое вещество находятся в разных по природе фазах, то растворимость всегда ограничена некоторым пределом. В разных системах этот предел различен. Например, предельное содержание кислорода в водном растворе невелико, диоксида углерода — больше, хлороводорода — еще больше. При комнатной температуре в стакане воды невозможно растворить столовую ложку поваренной соли, но можно растворить стакан сахарного песку.
При достижении предела растворимости между растворяемым веществом и образовавшимся раствором наступает равновесие.
Раствор, находящийся при данных условиях в равновесии с растворяемым веществом, называется насыщенным раствором.
Раствор, в котором при данных условиях предел растворимости не достигнут, называется ненасыщенным.
В некоторых случаях удается получить раствор, в котором растворенное вещества содержится больше, чем в насыщенном растворе. Такой раствор называется пересыщенным. Пересыщенные растворы неустойчивы, и иногда под действием случайных причин, например от сотрясения, избыток растворенное вещества может самопроизвольно выделиться из такое раствора.
Одной из важнейших характеристик раствора является относительное содержание в нем растворенного вещества и растворителя, которое называется концентрацией. В общем слу*ае концентрация обозначается обычно буквой С. Качественно растворы делятся на разбавленные, в которых растворенного вещества мало, и концентрированные (крепкие), в которых растворенного вещества много. Что значит мало и много — зависит исключительно от конкретной ситуации.
Количественно концентрация может выражаться самыми разными способами: отношением масс, объмов, чисел молей, массы к объему и, наоборот, числа молей к массе или объему и т. д. Поскольку раствор однороден, эти отношения могут быть найдены для любой части раствора.
В химии и смежных областях общепринятыми являются следующие способы выражения концентрации.
- 1. Отношение массы (объема, числа молей) растворенного вещества к общей массе (объему, числу молей) раствора — массовая (объемная, молярная) доля. Обычно находят отношение этих характеристик для 100 единиц раствора. Полученная таким образом величина в 100 раз больше соответствующей доли и называется массовой (объемной, мол я рной) процентной концентрацией. Объемные проценты обычно используются как характеристика газовых растворов, массовые и молярные проценты — во всех случаях.
- 2. Отношение числа молей растворенного вещества к объему раствора, выраженному в литрах, или, что-то же самое, число молей растворенного вещества в 1 л раствора — такой способ выражения называется молярной концентрацией (или мол я рностью).
Молярная концентрация имеет смысл не только в приложении к растворам, но может служить характеристикой и чистого вещества. Например, молярная концентрация тетрахлорида углерода в чистом индивидуальном веществе при 20 °C равна.
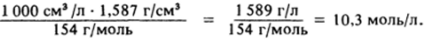
Концентрация воды в чистой воде при 4 °C 1 000 г/л/18 г/моль = = 55,56 моль/л, а при 20 °C 997/18 = 55,40 моль/л.
Поскольку объем раствора (особенно газового) зависит от температуры, а число молей растворенного вещества не зависит, то молярность раствора меняется в зависимости от температуры.
- 3. Отношение числа эквивалентов растворенного вещества к объему раствора, выраженному в литрах, или, что-то же самое, число эквивалентов растворенного вещества в 1 л раствора — такой способ выражения концентрации называется нормальной концентрацией (или нормальностью).
- 4. Отношение числа молей растворенного вещества к массе растворителя, выраженной в килограммах, или, что-то же самое, число молей растворенного вещества в 1 кг растворителя — такой способ выражения концентрации называется мол ял ьной концентрацией (или мол ял ьн о с т ь ю).
Поскольку ни число молей, ни масса не зависят от температуры, моляльность, в отличие от молярности, от температуры не зависит.
Многочисленность способов выражения концентрации обусловлена разнообразием практических задач.
Для того чтобы приготовить маринад для маринования грибов или огурцов, нет необходимости знать точное соотношение молей ионов натрия, водорода и ацетатных ионов. В этом случае процентная концентрация просто и надежно указывает состав раствора и готовить его удобно при любых количествах — на две литровые банки в домашних условиях или на 2 тыс. условных банок на консервном заводе.
Если же исследуется, например, механизм реакции между ионами в растворе, необходимо знать точное соотношение количеств ионов — в этом случае удобна молярная концентрация. Если же и растворитель участвует в процессе, например сольватируя растворенные частицы (см. разд. 8.3), то концентрация в молярных долях оказывается наиболее удобной.