Основные закономерности разделения водных смесей обратным осмосом

Существуют разные теории, с помощью которых объясняют механизм разделения электролитов обратным осмосом и влияние внешних факторов на этот процесс. Диффузионная модель. По этой модели мембрана является однородной системой. В ней растворяются вода и ионы, которые проникают через мембрану независимо друг от друга, при скоростях, соответствующих своим коэффициентам диффузии. В работах Сурираджан… Читать ещё >
Основные закономерности разделения водных смесей обратным осмосом (реферат, курсовая, диплом, контрольная)
Процесс обратного осмоса заключается в фильтровании раствора через полупроницаемую мембрану, которая пропускает растворитель и задерживает полностью или частично растворенное вещество. Для осуществления процесса со стороны концентрированного раствора необходимо создавать давление, величина которого должна превышать осмотическое давление системы[6]. Обычно применяемое на практике рабочее давление составляет 2−10 МПа.
В качестве мембран чаще всего используются полимерные пленки, которые должны обладать следующими свойствами: высокой разделяющей способностью, высокой удельной производительностью, химической стойкостью к действию сред разделяемой системы, механической прочностью, низкой стоимостью.
Мембраны могут быть сделаны из ряда полимеров [2−6], таких как целлюлоза, ароматические полиамиды, полиарилосульфоны, полиуретаны, полиакрлаты, производные галактозы и другие. Выбор того или иного материала должен зависеть от характеристик разделяемой среды.
Наиболее широкое применение находят анизотропные мембраны из ацетатацеллюлозы. Способ их формирования был разработан Лоэбом и Сурираджаном[7]. Полученные мембраны являются анизотропными и состоят из двух слоев: тонкий активный слой (толщиной — 0,25−0,5 мкм) и пористый слой (100−200 мкм), который работает как подложка и сам по себе не является селективным. Благодаря такой асимметричной структуре эти мембраны имеют высокую разделяющую способность, в то же время из-за тонкости селективного слоя у них низкое гидравлическое сопротивление для пермеата и высокая удельная производительность по растворителю.
Обратноосмотические мембраны характеризуются двумя основными параметрами; селективностью, и удельной производительностью, .
Селективность мембраны является мерой её способности задерживать растворенное вещество и математически выражается следующим отношением:
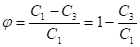
где: и - концентрация растворенного вещества в исходной смеси и в пермеате.
Удельная производительность,, при данном давлении выражается объемом (или массой) пермеата , пропускаемого в единицу времени ф, через единицу рабочей поверхности,, мембраны:
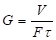
Существуют разные теории, с помощью которых объясняют механизм разделения электролитов обратным осмосом [2−7] и влияние внешних факторов на этот процесс. Диффузионная модель. По этой модели мембрана является однородной системой. В ней растворяются вода и ионы, которые проникают через мембрану независимо друг от друга, при скоростях, соответствующих своим коэффициентам диффузии. В работах [8−11] Сурираджан и сотрудники разработали модель избирательной адсорбции — капиллярного транспорта. Согласно этой модели разделение происходит благодаря поверхностным силам на границе мембрана-раствор. Ацетатцеллюлоза обладает положительной адсорбцией по воде и отрицательной адсорбцией по ионам. Таким образом, на пористой мембране образуется многомолекулярный слой связанной воды, которая проникает через поры, благодаря разности давления между двумя сторонами мембраны.
Дытнерский Ю.И. и сотрудники разработали капиллярно-фильтрационную модель[12], по которой мембрана считается пористой. На поверхности мембраны образуется слой воды с особой структурой, обладающей измененными свойствами по сравнению с водой в объеме. Вода в этом слое обладает пониженной растворяющей способностью. Толщина этого слоя уменьшает эффективный диаметр пор мембраны. Ионы рассматриваются как гидратированные частицы, диаметр которых в несколько раз больше, чем кристаллографический диаметр ионов. Ионы проходят через мембрану по конвективному механизму через поры, эффективный диаметр которых превышает диаметр гидратированных частиц. Таким образом, изменение концентрации происходит одним скачкой у поверхности мембраны.
Шервуд и Ясуда предполагают, что ионы и вода проходят через мембрану по двум параллельным механизмам. Одна часть из них растворяется в мембране и проходит через нее диффузией, благодаря разности концентрации по обеим сторонам мембраны. Другая часть проходит через большие, неселектнвные поры по механизму конвекции при скорости, которая зависит от разницы давления в системе.
Джонсон Г. и Боэсен разработали пористую модель, для которой трение между водой, растворенным веществом и материалом мембраны играет важнейшую роль в разделении.
Дерягин, Чураев, Мартынов и другие разработали модель, по которой селективность мембраны объясняется существованием поверхностных сил отталкивания между материалом мембраны и растворенным веществом. Поверхность мембраны может рассматриваться как энергетический барьер, который изменяет концентрацию ионов. После преодоления этого барьера ионы и вода проходят через поры мембраны по сложному механизму, который включает конвективный перенос, диффузию ионов в воде и взаимодействие со стенами пор. Вследствие этого вода двигается через поры при скорости, которая превышает скорость транспорта ионов и наблюдается снижение концентрации раствора по длине поры. На выходе из пор тоже присутствует энергетический барьер и тоже изменяется концентрация ионов.
В работах Духин и сотрудники предполагают, что при достаточно больших концентрациях исходного раствора опреснительную способность ацетатцеллюлозной мембраны можно связывать с её гидрофильностыо и с эффектом н ер ас творящего объема. На основе существующих исследований в области физической химии растворов вблизи поверхностей [13] авторы предлагают, что свойства воды в порах мембраны различаются от её свойств в объеме, например, снизится её диэлектрическая проницаемость и, следовательно, тоже снизится её растворяющая способность. Из-за этого в порах мембраны проявляется «нерастворяющий объем» воды.
В связи с этим стандартный химический потенциал иона в мембране становится больше и его концентрация меньше, чем в растворе. При этом ион рассматривается как аквакомплекс, который не теряет первичную оболочку воды гидратации при переходе границы мембраны. Авторы проводят строгий анализ изменения свободной энергии гидратированного иона при переходе в мембранную фазу.
Кочергин, Фомичев и Огневский разработали модель, согласно которой ацетатцеллюлозная мембрана является пористой и гидрофильной. Под действием поверхностных сил на мембране образуется слой воды с особенной структурой, в котором ассоциация между молекулами происходит в большей степени, чем в объеме и приводит к образованию «кластеров», которые по своим свойствам напоминают замерзшую воду. Вода в этом слое имеет особые свойства, например, обладает пониженной диэлектрической проницаемостью и повышенной вязкостью. Таким образом, вход ионов в мембрану можно рассматривать как переход в другую фазу. Селективность объясняется пониженной растворяющей способностью воды в порах мембраны и сильно зависит от среднего значения диаметра пор мембраны.
В настоящее время наиболее обоснованной представляется капиллярно — фильтрационная модель селективной проницаемости. Эта модель была предложена Сурираджаном и затем усовершенствована в работах Дытнерского Ю. И. и его сотрудников [14]. На поверхности и внутри пор гидрофильной мембраны, помещенной в водный раствор, образуется слой связанной воды. Вода может связываться с материалом мембраны, например, путем образования водородных связей с гидроксильными или карбоксильными группами ацетатцеллюлозы. В отличие от других полярных жидкостей вода обладает сеткой направленных водородных межмолекулярных связей. Благодаря этому, изменения во взаимном расположении молекул воды в граничном слое, обусловленные активными центрами на поверхности, распространяются на значительные расстояния от нее, медленно затухая, и могут простираться на десятки и даже сотни Ангстрем. Поэтому поры обратноосмотических мембран, имеющие размер порядка 10−30 ?, целиком заполнены связанной воды [15].
Связанная вода по своим свойствам существенно отличается от воды в свободном состоянии. У нее повышаются вязкость и плотность, снижается температура замерзания и уменьшается растворяющая способность. Поэтому для молекул и ионов растворенных веществ эта вода представляет особую фазу, в которую они проникают с некоторым коэффициентом распределения, который может быть значительно меньше единицы [16]. Степень проникновения ионов в слой связанной воды зависит от свойств мембраны и ионов. Чем гидрофильнее мембрана, чем больше на ней активных центров, тем толще слой связанной воды, тем значительнее ее свойства отличаются от свойств воды в объеме, тем меньше степень проникновения ионов в мембрану и выше селективность.
Среди свойств ионов определяющим является их гидратирующая способность. Явление гидратации заключается во взаимодействии ионов с молекулами воды в растворе. Различают первичную (ближнюю) и вторичную (дальнюю) гидратации [17]. Первичная заключается в прочном связывании молекул воды ионами вплоть до образования донорно-акцепторных связей. Вторичная представляет собой электростатическое взаимодействие молекул воды с первично гидратированными ионами. Молекулы воды, связанные непосредственно с ионом, образуют первичную гидратную оболочку. Число молекул воды в ней называют координационным числом гидратации.
Чем больше гидратирующая способность иона, тем сильнее связаны с ним молекулы воды, тем прочнее и толще гидратная оболочка, тем труднее иону проникнуть в слой связанной воды. Таким образом, мембраны с одинаковым размером пор, но изготовленные из разных материалов, будут иметь тем большую селективность, чем более гидрофильна их поверхность, а ионы на одной и той мембране задерживаются с тем большей селективностью, чем больше их гидратирующая способность [18].
Применительно к расчету селективности при разделении бинарных растворов сильных электролитов удалось получить довольно простой метод, основанный на теплотах гидратации ионов.
Теплота гидратации определяется уравнением:
Где — Hг энтальпия иона в газовой фазе в условиях вакуума, Hрэнтальпия иона в растворе.
Таким образом, теплота гидратации иона является энергетической характеристикой его взаимодействия с водой и может служить количественной мерой силы связи ион — вода. Теплота гидратации включает все энергетические эффекты (их около 10) при переносе иона из бесконечности в вакууме в раствор (одной из небольших составляющих теплоты гидратации, которую иногда путают с ней, является теплота растворения).
Рассмотрим бинарные растворы сильных электролитов. Они содержат одно растворенное вещество, которое диссоциировано на один сорт катиона и аниона:
Обозначим теплоту гидратации катиона как ДН+ и аниона ДН-. Примем для определенности, что ДН+> ДН-, а валентности катиона и аниона равны.
Рассмотрим, что будет происходить при осуществлении обратного осмоса.
В самый начальный момент ионы перераспределяются между раствором и мембраной, причем ионы с меньшей теплотой гидратации проникают в нее в большем количестве (рис.1).
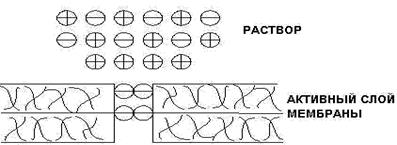
Рисунок 1. Схема перераспределения ионов между раствором и мембраной Преимущественное вхождение анионов в мембрану приводит к тому, что в приповерхностном слое мембраны их концентрация выше, чем катионов, и наоборот, в приповерхностном слое раствора выше концентрация катионов. Возникает двойной электрический слой, одна часть которого представлена избыточным положительным зарядом в фазе электролита, а другая — избыточным отрицательным зарядом в фазе мембраны (рис.2).
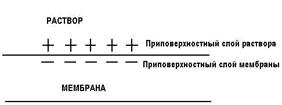
Рисунок 2. Схема двойного электрического слоя.
Возникшее электрическое поле будет тормозить дальнейшее продвижение анионов и ускорять прохождение катионов. В результате все ионы будут проходить практически с одинаковыми скоростями.
Это подтверждается экспериментально: катионы и анионы переходят через мембрану по сути эквивалентно. Лишь особо точные методы анализа показывают, что ионы с меньшей теплотой гидратации содержатся в пермеате чуть-чуть в большей концентрации, чем противоионы. Электронейтральность при этом обеспечивается благодаря ионам Н+ и ОН-, которые легко переходят через мембрану как из раствора в пермеат, так и из пермеата в раствор (поскольку теплоты гидратации этих ионов достаточно велики, можно сделать вывод, что механизм переноса этих ионов через мембрану совершенно своеобразен) [19].
С практической точки зрения можно считать, что селективность мембраны по катионам равна селективности по анионам. И это при разделении бинарных растворов дает право говорить о селективности в целом по растворенному веществу [20]. Напротив, говорить о селективности мембраны по конкретному иону не корректно, если не указывать противоиона. В таблице 1 показаны экспериментальные данные, полученные на одной из ацетатцеллюлозных мембран при разделении бинарных растворов хлоридов.
Таблица 1 Селективность по иону хлора в зависимости от катиона (его теплоты гидратации).
Соль. | ДН, кДж/моль. | цCl; | 1 — цCl; |
KCl. | 0,852. | 0,148. | |
NaCl. | 0,912. | 0,088. | |
LiCl. | 0,950. | 0,050. | |
BaCl2. | 0,982. | 0,018. | |
CoCl2. | 0,988. | 0,012. |
Из таблицы видно, что селективность по иону Clсущественно возрастает с увеличением теплоты гидратации катиона. При этом соотношение концентрации иона Clв пермеате и разделяемом растворе, равное (1 — цCl-), меняется более, чем в 12 раз в зависимости от вида соли, точнее сказать — от теплоты гидратации катиона [21].
Абсолютная величина истинной селективности зависит от теплоты гидратации катиона и аниона, а также от валентности иона с меньшей теплотой гидратации. Именно она определяет величину заряда двойного электрического слоя (ДЭС), поскольку ионы с меньшей теплотой гидратации первыми проникают в поры мембраны [22].
Экспериментально установлено, что в качестве усредненной энергетической характеристики взаимодействия соли с водой лучше всего использовать среднюю геометрическую величину теплот гидратации составляющих эту соль катионов и анионов:
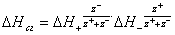
На основе вышеизложенных представлений был проведен анализ большого числа экспериментальных данных, полученных при разделении бинарных растворов сильных электролитов на ацетатцеллюлозных, стеклянных и некоторых других мембранах[23]. В результате удалось получить следующее соотношение для расчета истинной селективности мембран при разделении бинарных растворов сильных электролитов:
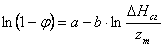
Здесь a и b — константы для данной мембраны при определенных условиях, zм — валентность иона с меньшей теплотой гидратации.
Значения констант a и b зависят от пористой структуры мембраны, ее материала и условий проведения обратного осмоса. При изменении температуры и давления константы будут меняться, при изменении концентрации электролита будут постоянными на ацетатцеллюлозных мембранах в диапазоне от ~2· 10−4 моль/литр до ~2· 10−1моль/литр[24]. При.
других концентрациях на ацетатцеллюлозных мембранах и практически при всех концентрациях на композитных мембранах могут меняться.