Влияние конкурирующих равновесий протонирования и комплексообразования на растворимость осадков

Расчеты показывают, что растворимость сульфидов MS (M — Pb, Cd, Cu, Hg) сильно (в 104 раз) возрастает при уменьшении рН от 7 до 3 и еще в 200−240 раз при изменении рН от 3 до 1 в основном из-за связывания сульфид-ионов в слабые кислоты HSи H2S. Растворимость фторидов MF3 (M — Sc, Y, La) при тех же изменениях рН возрастает в~2 и 40 раз в основном из-за связывания фторид-ионов в молекулы слабой… Читать ещё >
Влияние конкурирующих равновесий протонирования и комплексообразования на растворимость осадков (реферат, курсовая, диплом, контрольная)
В реальных условиях на равновесие растворения-осаждения могут оказывать существенное или сильное влияние конкурирующие равновесия протонирования и комплексообразования. В результате связывания ионов малорастворимого соединения в виде недиссоциированных форм слабого электролита (кислоты, основания, комплекса) растворимость осадков возрастает.
В присутствии слабых электролитов (органические кислоты) и неэлектролитов (спирты, кетоны) растворимость солей в воде понижается за счет изменения истинных коэффициентов активности ионов, если не образуются комплексы с катионом или анионом соли.
Влияние рН кислой водной среды
Если малорастворимое соединение (соль, гидроксид) содержит ионы с выраженными протолитическими свойствами, его растворимость зависит от водородного показателя (рН) кислой водной среды.
Растворимость солей, образованных анионами сильных кислот, возрастает несущественно при понижении рН среды от 7 до 1 благодаря солевому эффекту. Растворимость кристаллических галогенидов серебра и таллия (I) в воде и кислотах-неокислителях возрастает с увеличением степени ионности галогенидов (15 70%) в ряду I Br Cl F [5].
Для расчета условного произведения растворимости по уравнению (1.8) необходимые значения мольной доли xA свободных анионов Anслабой кислоты HnA определяют по обобщенному уравнению хA =.
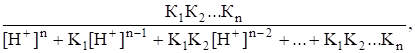
где К1, К2,…Кn — ступенчатые константы диссоциации слабой кислоты.
Для гетерогенного равновесия в кислоте-неокислителе.
MАn (т) + nH+ (p) Mn+ (p) + nHA (p),.
термодинамическая константа которого равна К = К, МАn / К, кислото-стойкость солей МАn (A- - F-, CN-, OCN-, NO, N и др.) рассчитывается по уравнению.
sn+1 =.
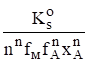
с использованием выражения.
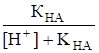
xA- = ,.
а при рН KHA, по приближенной формуле.
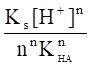
sn+1 ,.
где Ks — концентрационная константа растворимости соли МАn .
Для гетерогенного равновесия в кислоте-неокислителе.
MmАn (т) + 2nH+ (p) mM (2n/m)+ (p) + nH2A (p).
молярную растворимость соли, образованной анионом слабой кислоты Н2А, рассчитывают по уравнению.
sm+n =.
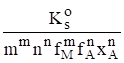
с использованием уравнения (1.14) при n = 2 для молярной доли хА, где, А — S2-, CO, SO, Se2- и др.
Приближенные формулы расчета растворимости могут быть выведены в зависимости от типа стехиометрии соединения MmAn и соотношения величин рК1 и рК2 слабой кислоты Н2А и рН среды. Например, растворимость малорастворимой соли типа МА, образованной катионом М2+ и анионом А2-, определяют по приближенным формулам:
а) при pH < pK1 (сульфиды MS, карбонаты MCO3).
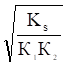
- s [H+] ;
- б) при рК1< pH < pK2 (сульфиты MSO3, селениты MSeO3)
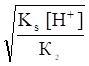
- s ;
- в) при рК2< pH (сульфаты MSO4, селенаты MSeO4, дихроматы MСr2O7)
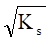
s .
Расчеты показывают, что растворимость сульфидов MS (M — Pb, Cd, Cu, Hg) сильно (в 104 раз) возрастает при уменьшении рН от 7 до 3 и еще в 200−240 раз при изменении рН от 3 до 1 в основном из-за связывания сульфид-ионов в слабые кислоты HSи H2S. Растворимость фторидов MF3 (M — Sc, Y, La) при тех же изменениях рН возрастает в~2 и 40 раз в основном из-за связывания фторид-ионов в молекулы слабой кислоты HF[5].
Пример 5. Какую избыточную концентрацию осадителя Na2C2O4 следует создать при рН 3, чтобы растворимость осадка СаС2О4 (К = 2,3 10−9) не превышала 10−6 моль / л? Ступенчатые константы диссоциации щавелевой кислоты К1 = 5,6 10−2 и К2 = 5,4 10−5 при 25С. Ионную силу раствора не учитывать.
Решение. Для гетерогенного равновесия в кислой среде СаС2О4 (к) Са2+ (р) + С2О (р).
10−6 C (Na2C2O4)x (C2O).
равновесную мольную долю оксалат-ионов вычисляем по формуле (1.14) при n = 2 и полученное значение 0,05 подставляем в выражение для константы растворимости оксалата кальция:
К = [Ca2+] [C2O] = 10−6 C (Na2C2O4) 0,05 = 2,3 10−9.
Затем находим С (Na2C2O4) 0,046 моль / л.
Пример 6. Может ли образоваться осадок СаF2 (К = 4,0 10−11) в растворе, содержащем 0,01 моль / л СаCl2, 0,01 моль / л KF и 0,06 моль / л HCl? KHF = 6,2 10−4. Решать с учетом ионной силы раствора.
Решение. Условием образования осадка СаF2 является соотношение [Ca2+] [F-]2 KS. В кислой среде с гетерогенным равновесием Са2+ (р) + 2F- (p) СаF2 (к) конкурирует гомогенное равновесие протонирования фторид-ионов в растворе.
F- + Н+ HF.
Общая ионная сила раствора равна 0,1 моль / л. Тогда коэффициенты активности ионов будут равны f (Ca2+)= 0,405, f (F-) = 0,755 [2], а концентрационная константа растворимости СаF2 составит 1,7 10−10. Мольную долю анионов Fвычисляем по формуле (1.14) при n = 1 и [H+] = CHCl = 0,06 M. Полученное значение x (F-) вместе с значениями [Ca2+]=0,01 М и [F-]= 0,01 x (F-) используем для определения ПКИ = 10−2 (10−2 0,0102)2= 1,04 10−10.
Так как ПКИ = [Ca2+] [F-]2< K, осадок СаF2 образоваться не может. Решение без учета ионной силы раствора приводит к неверному заключению.
Пример 7. При какой минимальной концентрации ионов водорода не будет выделяться осадок MnS (K = 2,5 10−10) в растворе 0,02 М по MnCl2 и 0,06 М по Na2S? Константы ионизации H2S равны К1=1,010−7иК2= 2,5 10−13 при 25С.
Решение. Осадок MnS не будет выделяться при условии [Mn2+] [S2-] < K. Рассмотрим гетерогенное равновесие.
MnS (к) + 2H+ (p) Mn2+ (р) + H2S (р),.
K = 1,5 10−9 рН 0,02 М К = 2,5 10−20.
которое смещается вправо при понижении рН раствора. При общей ионной силе электролита 0,24 М коэффициенты активности двухзарядных ионов равны 0,414 [2], а концентрационная константа растворимости MnS составит 1,5 10−9. Тогда [S2-] < 7,3 10−8 М, то согласно формуле (1.15) при n = 2 получаем уравнение.
[H+]2 + 10−7 [H+] - 2,05 10−14 = 0,.
решая которое, находим [H+]min = 1,02 10−7 М и рН = 6,99.
При строгом расчете растворимости в чистой воде осадка соли, содержащей анионы слабой кислоты, следует учитывать влияние гидролиза аниона. В результате частичного связывания анионов в недиссоциированные формы кислоты растворимость осадка возрастает.
Если без учета гидролиза растворимость осадка меньше 10−9 М, то ионы ОН-, образующиеся в результате гидролиза соли, практически не нарушают равновесие ионизации воды и [H+] = 10−7 М = const при 25С.