Метод Клемана-Дезорма с позиций электромагнитной теории теплоты

В стеклянный баллон объёмом несколько литров с помощью насоса нагнетается небольшая порция того же газа и кран К1 (см. рис. 1) закрывается. Спустя некоторое время температура газа вследствие теплообмена в баллоне сравняется с температурой окружающего воздуха. После этого водяным манометром меряют давление газа в баллоне. Состояние газа характеризуется давлением P1 и температурой T1. Затем… Читать ещё >
Метод Клемана-Дезорма с позиций электромагнитной теории теплоты (реферат, курсовая, диплом, контрольная)
Осталось прояснить лишь один вопрос, касающийся величины показателя адиабаты г. В физических справочниках приводятся совершенно отличные от результатов моего эксперимента величины показателей адиабаты, вроде как тоже полученные опытным путём:
- — для сухого воздуха при +20°С — 1,400 (в моём эксперименте — 1,29),
- — для гелия при +20°С — 1,660 (в моём эксперименте — 1,32).
К сожалению, в справочниках не принято указывать метод определения тех или иных физических величин, в частности, показателя адиабаты, что, на мой взгляд, в корне неправильно, так как отсутствие этой информации не позволяет оценить достоверность опубликованных данных.
Насколько можно судить, основным способом определения величины г до сих пор является метод Клемана-Дезорма. Во всяком случае, в подавляющем большинстве российских вузов студентов физических факультетов обучают именно этому методу.
Суть метода Клемана-Дезорма заключается в определении отношения Cp/CV, которое, как полагают и равно показателю адиабаты г. Сам метод я излагаю по одному из немногих толковых описаний этого метода, данному Д. В. Сивухиным в своём «Курсе общей физики» 2), среди множества других, (например 7), 8), 9), список можно продолжить):
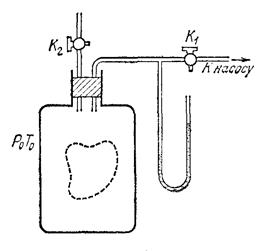
Рис. 12 Определение показателя адиабаты методом Клемана-Дезорма
В стеклянный баллон объёмом несколько литров с помощью насоса нагнетается небольшая порция того же газа и кран К1 (см. рис. 1) закрывается. Спустя некоторое время температура газа вследствие теплообмена в баллоне сравняется с температурой окружающего воздуха. После этого водяным манометром меряют давление газа в баллоне. Состояние газа характеризуется давлением P1 и температурой T1.
Затем на короткое время открывают кран K2. Часть газа выйдет из баллона, его давление сравняется с атмосферным P0. Температура газа при этом понизится. После закрывания крана К2 газ в баллоне медленно нагревается вследствие теплообмена, пока его температура вновь не сравняется с температурой окружающего воздуха T0. Давление газа в этот момент равно P2.
Таким образом, в моменты снятия отсчётов параметры, характеризующие состояние газа внутри баллона, имеют следующие значения:
- 1 состояние — P1 T0 V1 ,
- 2 состояние — P0 T V2 ,
- 3 состояние — P2 T0 V2 ,
Переход газа, из состояния 1 в состояние 2, по мнению авторов метода, совершается адиабатически, поэтому соответствующие изменения давления и объёма связаны уравнением адиабаты. Поэтому, основываясь на идеях молекулярно-кинетической теории (МКТ), можно вывести следующее уравнение:
Решая это уравнение относительно г, опять же, пользуясь положениями и формулами МКТ, получаем:
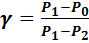
(40).
Полный вывод уравнения (40) на основании МКТ дан в 2).
Должен отметить, что авторы этого метода Клеман-Дезорм и его тесть Дезорм проявили творческий подход и отменную смекалку при его разработке, достойные всяческого уважения.
Основным недостатком этого метода следует считать тот факт, что определение показателя адиабаты производится не прямым способом. Этот метод определяет не показатель адиабаты, а некое отношение Cp/CV (это отношение я буду назвать «показатель Клемана-Дезорма»), которое, согласно ЭТТ, вовсе не равно показателю адиабаты, о чем свидетельствуют результаты прямых измерений величин давления при адиабатном сжатии и расширении.
Другим недостатком этого метода является то, что считающийся адиабатным процесс выпускания газа из баллона таковым не является, так как происходит слишком медленно. Например, в методическом руководстве Иркутского университета 7) сказано, цитирую: «теперь откроем кран на 1−2 секунды». Мой опыт при проведении описанного в части 1 статьи эксперимента свидетельствует о том, что для получения адиабатного процесса он должен длиться не дольше одной десятой доли секунды, а лучше — сотые или даже тысячные доли секунды (в этом случае не следует забывать о том, что возможно краткосрочное повышение давления из-за возникновения ударной волны).
Для большей наглядности того, как меняется состояние газа при методе Клемана-Дезорма, предлагаю провести теоретический расчёт по формулам ЭТТ. Представим реальную картину — пусть у нас имеется наполненный гелием при комнатных условиях при температуре 26,85°С (300 Кельвинов) стеклянный сосуд (см. рис. 8) объёмом 1 литр. При таких условиях в сосуде должно находиться около 2,68*1022 газовых молекул.
Посредством насоса закачаем в него еще немного гелия из другой ёмкости (какой-нибудь секстиллион с небольшим молекул, до количества 2,80*1022 штук) и подождём, пока температура газа сравняется с комнатной, получив состояние газа № 1 (см. таблицу 1). Давление внутри баллона в этом случае повыситься всего на 0,02 атм. Да-да, именно так — это вполне реальная картина. При использовании водяного манометра такое давление соответствует примерно 20 см водяного столба — вряд ли кто-либо использовал при экспериментах по методу Клемана-Дезорма более длинные стеклянные трубки.
После этого переведём газ в состояние № 2, для чего теоретически «откроем кран K2» на пару секунд и потом закроем его. При этом из сосуда вылетит некоторая часть молекул, вследствие чего давление в сосуде уменьшится. Согласно выражения (31):
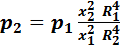
(41).
Определим параметры газа при состоянии № 2. Теоретически, при адиабатных процессах ни масса газовых молекул, ни электрический заряд газовой электронной оболочки, ни магнитный заряд молекулы не изменяются: .
Учитывая, что.
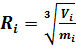
.
а при переходе из состояния № 1 в состояние № 2 емкость, в которой содержится исследуемый газ, остаётся прежней, то и объём, занимаемый газом, остаётся прежним:. Таким образом, уравнение (41) получает следующий вид:
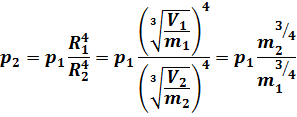
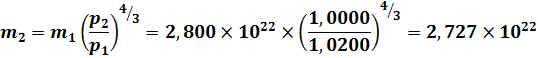
Очень важен вопрос, какая же должна получиться температура газа в состоянии № 2. Как можно видеть, современная теоретическая физика обходит этот очень важный вопрос стороной — у Д. В. Сивухина значится, что в состоянии № 2 газ внутри баллона имеет некую неопределенную температуру T.
Согласно ЭТТ,.
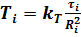
.
Отсюда:
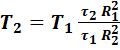
(42).
Подставим в это выражение значения ф и ф0 из уравнения (27). Учитывая, что при полнейшем отсутствии теплообмена, при 100%-но адиабатном процессе величина «заряда» x у газовых молекул не меняется, получим:
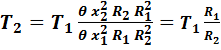
Таким образом:
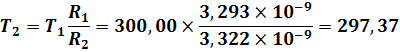
Теоретически определить давление газа внутри баллона после его изохорного нагревания до комнатной температуры (состояние № 3) не представляет труда. Согласно закона Шарля (второго закона Гей-Люссака):
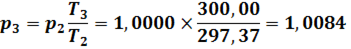
Все основные показатели газа в баллоне при его исследовании методом Клемана-Дезорма для удобства проверки сведены в таблицу 1.
Таблица 1 Теоретическое изменение основных показателей газа при определении отношения Cp/CV методом Клемана-Дезорма.
Состояние газа (по Д.В.Сивухину). | Давление p (атм). | Число молекул m (штук). | Температура газа T (Кельвинов). | Расстояние между молекулами R (метров). |
№ 1. | 1,0200. | 2,800*1022. | 300,00. | 3,293*10−09. |
№ 2. | 1,0000. | 2,727*1022. | 297,37. | 3,322*10−09. |
№ 3. | 1,0088. | 2,727*1022. | 300,00. | 3,322*10−09. |
Таки образом, получаем:
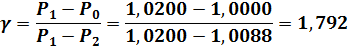
Такая величина показателя Клемана-Дезорма, равная 1,792 — максимально возможная. Она теоретически получается для абсолютно идеального газа при полнейшем отсутствии теплообмена, т. е. при 100%-но адиабатном процессе при переходе из состояния № 1 в состояние № 2. Напомню, что идеальным с точки зрения ЭТТ является одноатомный газ с главной эквипотенциальной поверхностью идеально сферической формы.
Реально полученные для инертных газов величины имеют значения на 0,12…0,13 меньше (~1,66…1,67). Объясняется это, в первую очередь, теплообменом между газом внутри баллона и самим баллоном, во время, как уже отмечалось, излишне длительного процесса перехода газа из состояния № 1 в состояние № 2.
Более низкие измеренные величины показателя Клемана-Дезорма (отношения Cp/CV) у двухатомных и многоатомных газов объясняются эллиптической формой главной эквипотенциальной поверхности, а также более интенсивным теплообменом. Дело в том, что согласно ЭТТ, каждый газ в тепловых диапазонах электромагнитного излучения инфракрасном имеет свои спектры излучения и поглощения, точно так же, и по тем же самым причинам, что и в световом и ультрафиолетовом диапазонах. Разумеется, интенсивность теплообмена между газами зависит от частот квантов теплового излучения. То есть тепловое излучение, испускаемое одним газом, например, азотом, может быть практически прозрачно для гелия или неона и наоборот.