Свойства растворов.
Общая и неорганическая химия
Определяемая экспериментально степень диссоциации б для сильных электролитов не отражает истинной картины относительного распада электролита на ионы. Опытным путем определяется так называемая «кажущаяся» степень диссоциации; она всегда ниже истинной степени диссоциации, которая для растворов сильных электролитов близка к единице. Те же теоретически рассчитанные величины для раствора той же… Читать ещё >
Свойства растворов. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
I. Значение темы Многие реакции в живых организмах протекают исключительно в водных растворах. Примерами растворов являются многие биологические системы: плазма крови, лимфа, внутриклеточная жидкость и др. Знание свойств водных растворов позволяет понять механизмы осмотического гомеостаза. Осмотическое равновесие лежит в основе регулирования водного баланса клеток. На основании закономерностей разбавленных растворов можно объяснить механизм действия изо-, гипери гипотонических растворов, применяемых в медицинской практике. Материал данной темы является необходимой базой для изучения отдельных разделов физической, коллоидной химии и аптечной технологии лекарственных форм.
II. Теоретические сведения.
Коллигативные свойства разбавленных растворов
Свойства растворов, которые не зависят от природы растворенного вещества, а определяющиеся числом частиц в растворе, называются коллигативными свойствами.
К коллигативным свойствам относят относительное понижение давления пара растворителя над раствором, понижение температуры замерзания и повышение температуры кипения растворов, осмотическое давление. Изучение свойств растворов показывает, что их поведение подчиняется ряду законов, которые необходимо учитывать в медицинской практике.
Закон Рауля
Относительное понижение давления пара растворителя над раствором нелетучего неэлектролита равно молярной доле растворенного вещества:
.
где ро — давление пара над чистым растворителем;
р — давление пара растворителя над раствором;
n — число молей растворенного вещества;
no — число молей растворителя Прямым следствием понижения давления пара растворителя над раствором являются изменения температур замерзания Дtзам и кипения Дtкип по сравнению со значением этих величин для чистого растворителя:
Согласно исследованиям Рауля повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора:

.
где b (x) — моляльная концентрация, моль/кг;
KЭ и KK — эбуллиоскопический и криоскопический коэффициенты растворителя, кг· К/моль.
Эти уравнения дают возможность вычислить молекулярную массу растворенного вещества по повышению температуры кипения раствора (эбуллиоскопический метод) или по понижению температуры замерзания (криоскопический метод).
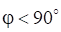
.
где М (х) — молярная масса растворенного вещества;
Дtкип(Дtзам) — изменение температуры кипения (замерзания), К;
m (x) — масса растворенного вещества, г;
mр-ля — масса растворителя, кг.
Осмос и осмотическое давление
Осмос — это одностороннее проникновение молекул растворителя через полупроницаемую мембрану из растворителя в раствор, или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическое давление — величина, измеряемая минимальным гидростатическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Закон Вант-Гоффа устанавливает зависимость осмотического давления от температуры и концентрации раствора:
.
где R — универсальная газовая постоянная,.
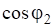
Т — абсолютная температура, К;
С (x) — молярная концентрация, моль/л Вопросы для самоконтроля.
- 1. От чего зависят свойства разбавленных растворов неэлектролитов? Почему они называются «коллигативными»?
- 2. Сформулируйте законы Рауля и напишите их математические выражения.
- 3. Каков физический смысл криоскопической и эбуллиоскопической констант?
- 4. Сформулируйте закон Вант-Гоффа и напишите его математическое выражение.
- 5. Чем обуславливается осмотическое давление биологических жидкостей?
- 6. Какие растворы называются изотоническими, гипотоническими, гипертоническими?
- 7. Чем отличается физиологический раствор от изотонического? Что такое осмос? Чем отличается осмос от диффузии?
- 8. Что произойдет с эритроцитами, если их поместить:
- а) в воду;
- б) в 0,09% раствор хлорида натрия;
- в) в 10% раствор хлорида натрия?
Как называются эти процессы?
III. Задачи с эталонами решения.
Алгоритм решения задач с использованием законов Рауля
Пример 1:
Давление пара воды при 25 оС составляет 3167 Па. Вычислите для той же температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы.
Алгоритм: | Решение: |
1. Запишите все данные условия задачи в сокращенной форме. | t =25 oC. pо = 3167 Па. mр-ра = 450 г. 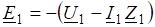 = 90 г. |
2. Запишите формулу для решения задачи. | |
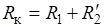 3. Подставьте все значения в формулы. |   моль. |
 4. Рассчитайте молярную долю растворителя. | |
 5. Найдите давление пара раствора. |
Пример 2:
Вычислите температуру кипения раствора, содержащего 100 г С12Н22О11 сахара в 750 г воды.
Алгоритм: | Решение: |
1. Запишите все данные условия задачи в сокращенной форме. |  = 100 г.  = 750 г Дtзам -? |
2. Запишите формулу для решения задачи. | |
 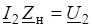 3. Подставьте все значения в формулу для определения понижения tзам (Дtзам). | |
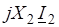 4. Определите tзам раствора. |
Алгоритм решения задач с использованием закона Вант-Гоффа
Пример 3:
Навеска неэлектролита массой 17,64 г была растворена в воде, а объем раствора доведен до 1 литра. Осмотическое давление оказалось равным 2,38· 105 Па при температуре 20оС. Определите молярную массу неэлектролита.
Решение:
На основании констант гетерогенного равновесия (ПР) можно рассчитывать растворимость труднорастворимых электролитов, решать принципиальный вопрос об образовании осадка в конкретных условиях. К гетерогенным равновесиям проявляют интерес биологи и медики. Процессы отложения и растворения минеральных компонентов костной ткани обусловлены сдвигами гетерогенного равновесия в организме.
При различных патологических состояниях в различных средах организма может начаться образование твердой фазы, например, образование мочевых камней (оксолат кальция, фосфат кальция, мочевая кислота) при почечнокаменной болезни, отложение карбоната кальция в стенке сосудов (кальциноз) и т. д.
II. Теоретические сведения Электролитами называют такие вещества, которые в растворах в большей или меньшей степени диссоциируют на ионы. В следствие этого в растворе электролита число частиц в некотором объеме будет больше, чем в равном ему по молярной концентрации растворе неэлектролита.
Если для раствора электролита, концентрация которого известна, найти опытным путем осмотическое давление, понижение давления пара, повышение температуры кипения, понижение температуры замерзания, то окажется, что эти величины больше теоретически вычисленных, а именно:
.
где — экспериментально определенные понижение температуры замерзания, повышение температуры кипения, осмотическое давление, понижение давления пара и число частиц соответственно;
— те же теоретически рассчитанные величины для раствора той же концентрации по уравнениям для разбавленных растворов неэлектролитов Множитель i, на который следует умножить вычисленные величины для того, чтобы они соответствовали опытным данным, называется изотоническим коэффициентом, или коэффициентом Вант-Гоффа.
Для растворов электролитов экспериментально полученные значения всегда больше теоретически вычисленных, то есть i > 1.
Для растворов электролитов формулы, выведенные для неэлектролитов, принимают следующий вид:
.
где b (x) — моляльная концентрация, моль/кг;
KЭ и KK — эбуллиоскопический и криоскопический коэффициенты растворителя, кг· К/моль;
i — коэффициент Вант-Гоффа.
.
где R — универсальная газовая постоянная,.
Т — абсолютная температура, К;
С (x) — молярная концентрация, моль/л;
i — коэффициент Вант-Гоффа.
.
где ро — давление пара над чистым растворителем;
р — давление пара растворителя над раствором;
n — число молей растворенного вещества;
no — число молей растворителя;
i — коэффициент Вант-Гоффа Для количественной характеристики состояния вещества в растворах вводится понятие о степени диссоциации. Степень электролитической диссоциации б — число, показывающее какая часть молекул электролита находится в растворе в виде ионов, то есть:
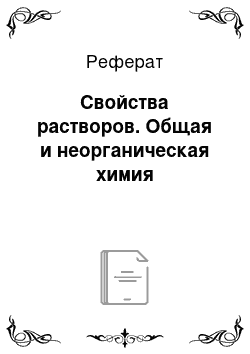
Определяемая экспериментально степень диссоциации б для сильных электролитов не отражает истинной картины относительного распада электролита на ионы. Опытным путем определяется так называемая «кажущаяся» степень диссоциации; она всегда ниже истинной степени диссоциации, которая для растворов сильных электролитов близка к единице.
Связь между коэффициентами i и б определяется уравнениями:
.
где n — число ионов, образующих молекулу данного электролита.
Гетерогенные равновесия
Произведение растворимости
В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком и ионами электролита в растворе.
В насыщенном растворе малорастворимого электролита произведение концентраций его ионов при данной температуре является величиной постоянной. В общем виде для малорастворимого соединения АnBm:
Условием образования осадка является превышение произведения концентраций ионов (ИП) малорастворимого электролита над его произведение растворимости (ПР).
ИП>ПР
Если ИП<ПР, то осадок не образуется, так как раствор насыщен. Если ИП=ПР, то раствор насыщен, в нем наступает равновесие и осадок не образуется.
Используя значение ПР можно вычислять растворимость (S) малорастворимых электролитов, выраженную в моль/л, г/л.
- 1) для бинарных электролитов типа АВ:
- 2) для тринарных электролитов А2В или АВ2:
- 3) для тетрарного электролита типа А3В или АВ3:
III. Вопросы для самоконтроля.
- 1. Что называют изотоническим коэффициентом? Каков его физический смысл? От каких факторов зависят значения i?
- 2. Напишите формулу для определения «кажущейся» степени диссоциации.
- 3. Объясните существование термина «кажущаяся» степень диссоциации.
- 4. Что характеризует константа диссоциации и степень диссоциации электролита?
- 5. Что называют активной концентрацией или активностью? В каком соотношении она находится с аналитической концентрацией?
- 6. Что называют фактором активности, и как изменяется его значение при разбавлении растворов?
- 7. Что называют ионной силой раствора, и чем она определяется? Как изменяется ее значение с увеличением числа различных ионов, присутствующих в растворе, с увеличением заряда и концентрации каждого иона?
- 8. Сформулируйте закон Оствальда, напишите его математическое выражение.
- 9. Что называют произведение растворимости? Какое свойство вещества характеризуется этой величиной?
- 10. Применимо ли это понятие к таким веществам как хлорид натрия, сульфат меди (II)? Почему?
- 11. Как называются растворы, в которых произведение концентрации ионов труднорастворимого электролита:
- а) больше ПР;
- б) меньше ПР;
- в) равно ПР?
- 12. Предложите реактив, при добавлении которого к системе осадок растворится. Дайте объяснение.
- 13. Перечислите условия образования и растворения осадков в системах.
- 14. Какой осадок (в равных условиях) образуется в первую очередь: фторида кальция или оксалата кальция? ПР (CaF2)=4· 10-11; ПР (CaС2О4)=2· 10-9. Ответ подтвердить расчетом.
IV. Задачи с эталонами решения.
Пример 1:
При какой молярной концентрации раствора степень диссоциации HNO2 будет равна 20%, если ее константа диссоциации равна 5· 10-4 моль/л?
Решение:
- 1)
- 2)
- 3)
Пример 2:
Чему равна ионная сила (моль/л) 0,2 М раствора сульфата магния, применяемого для внутримышечного введения?
Решение:
- 1)
- 2)
- 3)
Алгоритм решения задач по определению «кажущейся» степени диссоциации (б)
Пример 3:
При 0оС осмотическое давление раствора карбоната натрия с концентрацией 0,1 моль/л равно 272,6 кПа. Определить «кажущуюся» степень диссоциации.
Решение:
Алгоритм: | Решение: |
Алгоритм: | Решение: |
1. Оформите сокращенную запись условия задачи. | росм = 2,38· 105 Па. Т = 273 + 0 = 273 К. R = моль/л. -? |
2. Запишите формулу для определения изотонического коэффициента, исходя из условия задачи. | |
3. Рассчитайте изотонический коэффициент и определите число частиц (N) для данного электролита. | n = 3. |
4. Напишите формулу, связывающую изотонический коэффициент и «кажущуюся» степень диссоциации и определите б. |
Пример 4:
Температура кипения раствора NH4Cl, полученного растворением соли массой 1,07 г в 200 мл воды, равна 100,09оС. Определить степень диссоциации (б %) соли в этом растворе.
Решение:
Алгоритм: | Решение: |
1. Запишите все данные условия задачи в сокращенной форме. | росм = 2,38· 105 Па. Т = 273 + 0 = 273 К. R = моль/л. -? |
2. Запишите формулу для определения изотонического коэффициента, исходя из условия задачи. | |
3. Рассчитайте изменение температуры кипения и моляльную концентрацию. | |
4. Рассчитайте изотонический коэффициент и определите число частиц для данного электролита. | N=2. |
5. Напишите формулу, связывающую изотонический коэффициент и «кажущуюся» степень диссоциации и определите б. |
Алгоритм решения задач на вычисление рН раствора и концентраций ионов Н+ и ОН-
Пример 5:
Вычислите рН раствора, если концентрация ионов водорода равна 7,4 · 10-3 моль/л (lg 7,4 = 0,87).
Решение:
Пример 6:
Определите концентрацию ионов ОНв растворе NH4OH (С=0,01 моль/л, Кд = 1,8 · 10-5). Рассчитайте рН этого раствора (lg 4,2 = 0,63).
Решение:
NH4OH — слабый электролит и диссоциирует обратимо:
Концентрация ионов:
Пример 7:
Вычислите молярную концентрацию муравьиной кислоты (рH= 3, Кд = 1,8 · 10-4).
Решение:
HCOOH — слабый электролит и диссоциирует обратимо:
Концентрация ионов:
Так как рН = 3, то [Н+] = 10-3.
Алгоритм решения задач на определение величины растворимости по массе или концентрации труднорастворимого электролита
Пример 8:
В 2 литрах раствора при 20оС содержится 0,326 г сульфата кальция. Определить ПР этой соли.
Решение:
Алгоритм: | Решение: |
1. Определить массу сульфата кальция в литре растворе. | |
2. Рассчитать молярную концентрацию сульфата кальция. | |
3. Написать уравнение диссоциации и определить концентрации ионов. | |
4. Рассчитать ПР. |
Пример 9: Определение растворимости труднорастворимого электролита по величине ПР Произведение растворимости сульфата бария составляет 1,1 · 10-10. Вычислите растворимость соли в моль/л и г/л.
Пример 10: Прогнозирование образования осадка Выпадет ли осадок при смешивании 0,2 л 0,02 М раствора сульфата цинка и 0,6 литра 0,008 М раствора сульфида натрия, если ПР(ZnS) = 1,1 · 10-21 (моль/л)2?
Решение:
Алгоритм: | Решение: |
1. Написать уравнение диссоциации солей исходных растворов и определить концентрации ионов, образующих осадок. | |
2. Изобразить схему равновесия в насыщенном растворе над осадком. | При сливании растворов пойдет реакция: |
3. Определить концентрации ионов после смешивания. | |
4. Рассчитать значение произведения концентраций ионов в данном растворе (ИП). | |
5. Сравнить значения ИП и ПР, сделать вывод о возможности образования осадка. | осадок образуется. |
V. Задачи для самостоятельного решения.
- 1. Давление водяного пара над раствором 24,8 г KСl в 100 г воды при 100оС равно 9,14· 104 Па. Вычислите изотонический коэффициент, если давление водяного пара при этой температуре равно 1,0133· 105 Па.
- 2. Температура кипения водяного раствора NaOH равна 102,65 оС, а степень диссоциации =70%. Определите массу (г) растворенного NaOH в 100 г воды.
- 3. Температура замерзания водного раствора, содержащего 0,25 моль азотной кислоты в 2,5 л воды, равна -0,35 оС. Рассчитайте «кажущуюся» степень диссоциации кислоты в этом растворе.
- 4. Определите ионную силу (моль/л) раствора NaCl с, применяющегося для инъекций.
- 5. В 1 л 0,5 М раствора электролита содержится 3,612· 1023 частиц (молекул и ионов) растворенного вещества. Определите изотонический коэффициент i раствора.
- 6. В насыщенном растворе сульфата свинца определите концентрацию ионов свинца, сульфат-ионов и растворимость соли в моль/л и г/л, если
- 7. В 500 мл воды при 18оС растворяется 0,0166 г хромата серебра. Чему равно произведение растворимости этой соли?
- 8. Будет ли образовываться осадок при смешивании 5 мл раствора Na2SO4 с С=10-2 моль/л и 95 мл CaCl2 с С = 10-2 моль/л, если ?
- 9. Выпадет ли осадок йодида серебра, если слить два раствора — 200 мл нитрата серебра (С = 0,05 моль/л) и 500 йодида калия (С = 0,008 моль/л)?
- 10. Выпадет ли осадок, если смешать равные объемы двух растворовнитрата серебра (С = 0,001 моль/л) и хромата калия (С = 0,005 моль/л)?
VI. Литература для самоподготовки.
- 1. Н. А. Глинка. Общая химия. — Л., 1979 и др. — Гл. VIII, С 257−263.
- 2. А. С. Ленский Введение в бионеорганическую и биофизическую химию. — М., 1993. — С. 126−143, 146−150, 160−165.
- 3.. Ю. А. Ершов, В. А. Попков и др. Общая химия. — М., 1993. — С. 79−95, 120−131.
- 4. В. Д. Пономарев. Аналитическая химия. — М., 1982. — С. 56−59, гл. IV — С. 109−125.
- 5. Лекции.