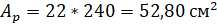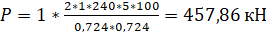Константа нестойкости. Двойные соли
При растворении в воде комплексные соединения обычно распадаются так, что внутренняя сфера ведет себя как единое целое:
[Ag (NH3)2]Cl[Ag (NH3)2]+ +Cl;
K[Ag (CN)2] К+ + [Ag (СN)2]-.
Наряду с этим процессом, хоть и в незначительной степени, происходит диссоциация внутренней сферы комплекса (т.е. процесс обратим):
[Ag (NH3)2]+ Ag+ + NH3.
[Ag (CN)2]- Ag+ + 2CN-.
Применив к этим равновесиям выражение для константы ионизации, получим соотношение, называемое константой нестойкости комплекса:
;
Константа неустойкости комплексного иона Кн характеризует прочность (или устойчивость) внутренней сферы комплексного соединения: чем меньше Кн, тем более устойчив комплексный ион. В приведенных примерах комплексный ион [Ag (CN)2]- более устойчив, чем комплексный ион [Ag (NH3)2]+, поэтому второй ион может быть легко разрушен за счет образования первого иона:
[Ag (NH3)2]+ + 2СN- = [Ag (CN)2]- + 2NH3.
Двойные соли также относятся к числу комплексных соединений, ибо принципиального различия между двойными солями и комплексными соединениями нет. Отличаются они лишь диссоциацией комплексного иона: у первых она практически полная. у вторых — незначительная. Например, двойной хлорид калия и меди 2KCl • CuCl2 • 2H2O можно рассматривать как комплексное соединение К2[CuCl4] • 2H2O диссоциация которого происходит следующим образом:
К2[CuCl4] • 2H2O = 2К+ + [CuCl4]2- + 2H2O;
[CuCl4]2- - Cu2+ + 4Cl-.
В данном случае комплексный ион устойчив только в концентрированных растворах, при комнатной температуре константа неустойкости этого иона велика.