Лекция по теме: «Электролитическая диссоация.
Растворы электролитов

Для количественной оценки электролитической диссоциации используется понятие степени электролитической диссоциации () — отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Степень диссоциации определяется опытным путем и выражается в долях или процентах. Степень электролитической диссоциации зависит от природы растворителя и растворяемого вещества, температуры… Читать ещё >
Лекция по теме: «Электролитическая диссоация. Растворы электролитов (реферат, курсовая, диплом, контрольная)
Все вещества по способности в растворе или в расплавленном состоянии проводить электрический ток можно подразделить на две группы: электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания и соли.
Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят. Например, многие органические вещества.
Способность электролитов (проводников II рода) проводить электрический ток принципиально отличается от электропроводности металлов (проводников I рода): электропроводность металлов обусловлена движением электронов, а электропроводность электролитов связана с движением ионов.
Было обнаружено, что в растворах кислот, оснований и солей экспериментально найденные значения p, tкрист., tкип., pосм, больше теоретически рассчитанных для того же раствора по его молярной концентрации в i раз (i — изотонический коэффициент). Причем число частиц в растворе NaCl увеличилось почти в 2 раза, а в растворе СаCl2 — в 3 раза.
Для объяснения особенностей поведения электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория, получившая название теории электролитической диссоциации. Сущность теории состоит в следующем:
- 1. Электролиты при растворении в воде распадаются (диссоциируют) на заряженные частицы (ионы) — положительно заряженные катионы (Na+, K+, Ca2+, H+) и отрицательно заряженные анионы (Cl-, SO42-, CO32-, OH-). Свойства ионов совершенно иные, чем у образовавших их атомов. Распад нейтрального вещества на ионы в результате химического взаимодействия с растворителем называют электролитической диссоциацией.
- 2. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду).
- 3. Диссоциация — процесс обратимый и равновесный. Это означает, что параллельно с распадом молекул на ионы (диссоциация), идет процесс соединения ионов в молекулы (ассоциация): КА К+ + А-.
- 4. В растворе ионы находятся в гидратированном состоянии.
Для количественной оценки электролитической диссоциации используется понятие степени электролитической диссоциации () — отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул. Степень диссоциации определяется опытным путем и выражается в долях или процентах. Степень электролитической диссоциации зависит от природы растворителя и растворяемого вещества, температуры и концентрации раствора:
- 1. Чем более полярен растворитель, тем выше степень диссоциации в нем электролита.
- 2. Диссоциации подвергаются вещества с ионной и ковалентной полярной связью.
- 3. Повышение температуры, увеличивает диссоциацию слабых электролитов.
- 4. При уменьшении концентрации электролита (при разбавлении) степень диссоциации увеличивается.
В зависимости от величины степени диссоциация условно электролиты (при концентрации их растворов 0,1 М) делят на:
Сильные (>0,3). | Средние (0,03<<0,3). | Слабые (<0,03). |
| 1. некоторые кислоты: H2SO3, H3РO4. | 1. органические кислоты: НСООН, СН3СООН;
|
По виду образующихся при диссоциации ионов все электролиты можно разделить на кислоты, основания, соли.
Кислоты — электролиты, диссоциирующие с образованием только катионов H+ и кислотного остатка (Cl- - хлорид, NO3— - нитрат, SO42- — сульфат, HCO3 гидрокарбонат, CO32 карбонат). Например: НСl Н++Сl-, H2SO4 2Н++SO42-.
Наличие в растворах кислот иона водорода, точнее, гидратированного иона Н3O+, обусловливает общие свойства кислот (кислый вкус, действие на индикаторы, взаимодействие со щелочами, взаимодействие с металлами с выделением водорода и пр.).
В многоосновных кислотах диссоциация происходит ступенчато, причем каждая ступень характеризуется своей величиной степени диссоциации. Так, ортофосфорная кислота диссоциирует по трем ступеням:
I ступень. | H3РO4 Н+ + H2РO4; | 1 = 20%,. |
II ступень. | H2РO4— Н+ + HРO42; | 2 = 0,11%,. |
III ступень. | HРO42- Н+ + РO43- | 3 = 0,001%,. |
Причем 3<2<1, т. е. распад электролита на ионы протекает, в основном, по первой ступени и в растворе ортофосфорной кислоты будут находиться преимущественно ионы Н+ и H2РO4-. Причины этого в том, что ионы водорода значительно сильнее притягиваются к трехзарядному иону РO43- и двухзарядному иону HРO42-, чем к однозарядному H2РO4-. Кроме того, на 2-ой и 3-ей ступенях имеет место смещение равновесия в сторону исходной формы по принципу Ле-Шателье за счет накапливающихся ионов водорода.
Основания — электролиты, диссоциирующие с образованием в качестве анионов только гидроксид-ионы (OH-). После отрыва OHостаются катионы: Na+, Cа2+, NH4+. Например: NaOH Na+ + ОН-, Са (ОН)2 Са2+ + 2 OН-.
Общие свойства оснований (мыльность на ощупь, действие на индикатор, взаимодействие с кислотами и пр.) определяются наличием в растворах оснований гидроксо-группы ОН-.
Для многокислотных оснований характерна ступенчатая диссоциация:
I ступень. | Ва (ОН)2 Ва (ОН)+ + OН; |
II ступень. | Ва (ОН)+ Ва2+ + OН; |
Диссоциация амфотерных гидроксидов протекает как по типу основания, так и по типу кислоты. Так, диссоциация гидроксида цинка может протекать по следующим направлениям (при этом равновесие сдвигается в зависимости от среды по принципу Ле-Шателье):
в кислой среде. | ||
ZnО22- + 2Н+ Zn (ОН)2 Zn2+ + 2 ОН; | ||
[Zn (Н2О)4]2+ + 2 ОН; | Zn (ОН)2 + 4 Н2О. | [Zn (ОН)4]2- + 2Н+ + 2Н2О. |
в щелочной среде. |
Соли — это электролиты, диссоциирующие на катионы металла (или заменяющих его групп) и анионы кислотного остатка.
Средние соли диссоциируют полностью: CuSO4 Cu2+ + SO42-. В отличие от средних солей, кислые и основные соли диссоциируют ступенчато:
I ступень. | NaНСО3 Na+ + НСО3; | Сu (ОН)Cl Сu (ОН)+ + Cl; |
II ступень. | НСО3— Н+ + СО32- | Сu (ОН)+ Сu2+ + OН-,. |
причем степень диссоциации солей по второй ступени очень мала.
Реакции обмена в растворах электролитов — это реакции между ионами. Необходимым условием протекания реакций обмена в растворах электролитов является образование слабодиссоциирующих соединений или соединений, выделяющихся из раствора в виде осадка или газа.
При написании уравнений реакций в ионно-молекулярном виде слабодиссоциирующие, газообразные и труднорастворимые соединения записывают в виде молекул, а растворимые сильные электролиты — в виде ионов. При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде (Приложение А).
Рассмотрим методику написания ионных уравнений на примерах.
Пример 1. Напишите в ионно-молекулярной форме уравнение реакции:
ВаСl2 + K2SО4 = ВаSО4 + 2KСl.
Решение: Соли являются сильными электролитами и практически полностью диссоциируют на ионы. Так как ВаSО4 — практически нерастворимое соединение (см. таблицу приложения А), основная часть сульфата бария будет находиться в недиссоциированном виде, поэтому это вещество запишем в виде молекул, а остальные соли, являющиеся растворимыми, в виде ионов:
Ва2+ + 2Сl- + 2K+ + SО42- = ВаSО4 + 2K+ + 2Сl;
Как видно из полученного полного ионно-молекулярного уравнения, ионы K+ и Сlне взаимодействуют, поэтому, исключив их, получим краткое ионно-молекулярное уравнение:
Ва2+ + SО42- = ВаSО4 ,
Стрелка показывает, что образующееся вещество выпадает в осадок.
Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. Причем суть любой химической реакции отображает именно краткое ионно-молекулярное уравнение. На основании ионно-молекулярного уравнения можно легко написать молекулярное.
Пример 2. Подберите молекулярное уравнение к следующему ионно-молекулярному уравнению:
2Н+ + S2- = Н2S.
Решение: Ионы водорода образуются при диссоциации любой сильной кислоты, например НСl. К ионам водорода в кратком ионном уравнении необходимо добавить два иона хлора. К сульфид-ионам следует добавить катионы (например, 2K+), образующие растворимый, хорошо диссоциирующий электролит. Затем такие же ионы нужно написать в правой части. Тогда полное ионно-молекулярное и молекулярное уравнения будут иметь вид:
- 2Н+ + 2Сl- + 2K+ + S2- = Н2S + 2K+ + 2Сl-
- 2 НСl + K2S = Н2S + 2 KСl-
Сильные электролиты В водных растворах сильные электролиты полностью диссоциированы, поэтому даже при малых концентрациях растворов энергия электростатического взаимодействия между ионами довольно велика, и пренебречь этим нельзя. Взаимодействие противоположно и одноименно заряженных ионов (притяжение и отталкивание) приводит к тому, что вблизи каждого иона находятся ионы с противоположным зарядом, образующие его ионную атмосферу. Радиус ионной атмосферы сравнительно велик, поэтому ионные атмосферы соседних ионов пересекаются и образуются ионные пары; кроме того, каждый ион окружен дипольными молекулами растворителя — сольватной оболочкой (гидратной, если растворитель — вода). Этот процесс называется ассоциацией:
АВ + (x+y)Н2О А+xН2О + В-yН2О А+xН2О + В-yН2О А+xН2О • В-yН2О.
гидратированные ионы ионная пара
Чем выше концентрация раствора сильного электролита, тем больше вероятность образования ионных пар. Так в растворе возникает подобие пространственной структуры, что ограничивает свободу перемещения ионов и приводит к изменению свойств раствора. Поэтому опытно определяемые коллигативные свойства (p, tкрист., tкип., pосм), зависящие от общего числа частиц в растворе, оказываются меньше рассчитанных в предположении полной диссоциации. Так, для раствора К2SO4 экспериментально получено значение б=71%, а не 100%. Поэтому, определяя степень диссоциации раствора сильного электролита, получают кажущуюся степень диссоциации — величину б с поправкой на межионное взаимодействие. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
Для оценки состояния ионов в растворе и возможности пользоваться соотношениями, выведенными для идеальных растворов, введено понятие активности электролита (а), равной произведению коэффициента активности (f) на концентрацию (С): а = f•С. Коэффициент активности f характеризует степень отклонения свойств данного раствора от идеального.
Слабые электролиты При растворении в воде слабого электролита устанавливается динамическое равновесие между недиссоциированными молекулами и продуктами их диссоциации — ионами. Количественной характеристикой данного равновесия является константа диссоциации (Кд). Так, например, для некоторого электролита АaВb, в растворе которого установилось равновесие:
АaВb aАx+ + bВy-
константа диссоциации выражается следующим соотношением:
Кд =. | [Аx+]a • [Вy-]b. |
[АaВb]. |
Чем больше Кд, тем сильнее электролит. Если диссоциация протекает ступенчато, то каждой ступени отвечает своя Кд, как и своя степень диссоциации.
Константа и степень диссоциации связаны между собой. Рассмотрим это на примере электролита, распадающегося на два иона по уравнению: АВ А++В-. Константа диссоциации такого равновесия будет иметь вид:
Кд =. | [А+] • [В-]. |
[АВ]. |
Пусть C молярная концентрация раствора, — степень диссоциации, тогда концентрация продиссоциировавших частиц (А+ и В-) будет равна C, а непродиссоциировавших (АВ) (1-)C. Тогда.
Кд =. | © • ©. | =. | 2 C. |
(1-)C. | 1; |
Так как для разбавленных растворов малая величина («1), то можно считать, что 1-?1. Тогда получаем соотношение (закон разбавления Оствальда):
Kд? C2 или =.
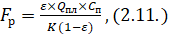
Значения Kд для слабых электролитов невелики. Например, для диссоциации уксусной кислоты Kд = 1,810-5, что свидетельствует о том, что равновесие значительно смещено в сторону молекулярной формы.
По принципу Ле-Шателье эндотермический процесс диссоциации протекает более глубоко при увеличении температуры и связывании продуктов реакции.